: Khí metan(CH4) được dung làm nhiên liệu, khi đốt cháy trong không khí tỏa nhiều nhiệt. Tính thể tích O2 và thể tích không khí cần để đốt cháy hoàn toàn 4,48 lít khí CH4. Biết rằng thể tích các khí đo ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nCH4 = 4,48/22,4 = 0,2 (mol)
PTHH: CH4 + 2O2 -> (t°) CO2 + 2H2O
Mol: 0,2 ---> 0,4
Vkk = 0,4 . 22,4 : 21% = 128/3 (l)

a) Theo phương trình hóa học, ta thấy nếu đốt cháy hết 1 mol phân tử khí CH4 thì phải cần 2 mol phân tử khí O2. Do đó thể tích khí oxi cần dùng để đốt cháy hoàn toàn 2 lít khí metan là:
VO2 = 2 . 2 = 4 lít.
b) Theo phương trình phản ứng, khi đốt cháy hoàn toàn 0,15 mol khí metan thì cũng sinh ra 0,15 mol khí cacbon đioxit. Do đó thể tích khí CO2 thu được là:
VCO2 = 0,15 . 22,4 = 3,36 lít.
c) Tỉ khối của khí metan và không khí là:
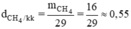
Vậy khí metan nhẹ hơn không khí 0,55.

\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ n_{CH_4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{CO_2}=n_{CH_4}=0,2\left(mol\right)\\ n_{O_2}=2.n_{CH_4}=2.0,2=0,4\left(mol\right)\\ a,V_{kk}=5.V_{O_2\left(đktc\right)}=5.\left(0,4.22,4\right)=44,8\left(l\right)\\ b,m_{CO_2}=0,2.44=8,8\left(g\right)\)

nCH4 = 4,48/22,4 = 0,2 (mol)
PTHH: CH4 + 2O2 -> (t°) CO2 + 2H2O
Mol: 0,2 ---> 0,4 ---> 0,2 ---> 0,4
Vkk = 0,2 . 5 . 22,4 = 44,8 (l)
mCO2 = 0,2 . 44 = 8,8 (g)
mH2O = 0,4 . 18 = 7,2 (g)
PTHH: Ca(OH)2 + CO2 -> CaCO3 + H2O
Mol: 0,2 <--- 0,2 ---> 0,2
mCaCO3 = 0,2 . 100 = 20 (g)

nCH4 = 6,72/22,4 = 0,3 (mol)
PTHH: CH4 + 2O2 -> (t°) CO2 + 2H2O
Mol: 0,3 ---> 0,6
Vkk = 0,6 . 22,4 : 21% = 64 (l)

CH4 + 2O2 ---to--> CO2 + 2H2O
nCH4 = 4,48 : 22,4 = 0,2 (mol)
--> VO2 = 0,2 x 2 x 22,4 = 8,96 (l)
--> Vkk = 8,96 x 5 = 44,8 (l)
nhá