Cho bột sắt dư vào dung dịch H2SO4 loãng thu được V lít H2 (đktc) và dung dịch có chứa m1 gam muối. Mặt khác, cho bột sắt dư vào dung dịch H2SO4 đặc, nóng thu được V lít SO2 (đktc) và dd có chứa m2 gam muối. So sánh m1 và m2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
Cho Fe dư + H2SO4 → m1 gam muối + V lít H2
Fe + 2H+ → Fe2+ + H2↑
nFe2+ = nH2 = V/22,4
→ m1 = mFeSO4 = V/22,4 × 152 gam.
Cho Fe + H2SO4 đặc, nóng
→ m2 gam muối + V lít SO2
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
nFe2(SO4)3 = 1/3 × nSO2 = 1/3 × V/22,4 mol
→ m2 = mFe2(SO4)3 = 1/3 × V/22,4 × 400 gam
→ m1 > m2

Đáp án :C
Cho Fe dư + H2SO4 → m1 gam muối + V lít H2
Fe + 2H+ → Fe2+ + H2↑
nFe2+ = nH2 = V/22,4 → m1 = mFeSO4 = V/22,4 × 152 gam.
• Cho Fe + H2SO4 đặc, nóng → m2 gam muối + V lít SO2
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
nFe2(SO4)3 = 1/3 × nSO2 = 1/3 × V/22,4 mol → m2 = mFe2(SO4)3 = 1/3 × V/22,4 × 400 gam
→ m1 > m2

Đáp án C
- Cho Fe dư + H2SO4 → m1 gam muối + V lít H2
Fe + 2H+ → Fe2+ + H2↑
nFe2+ = nH2 = V/22,4 → m1 = mFeSO4 = V/22,4 × 152 gam.
- Cho Fe + H2SO4 đặc, nóng → m2 gam muối + V lít SO2
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
nFe2(SO4)3 = 1/3 × nSO2 = 1/3 × V/22,4 mol
→ m2 = mFe2(SO4)3 = 1/3 × V/22,4 × 400 gam
→ m1 > m2

Đáp án B
Cu(OH)2↓ + 4NH3 → [Cu(NH3)4](OH)2
AgCl↓ + 2NH3 → [Ag(NH3)2]Cl
Ni + NH3 → không phản ứng.
Zn(OH)2↓ + 4NH3 → [Zn(NH3)4](OH)2
Pb + NH3 → không phản ứng.
Sn + NH3 → không phản ứng.
→ Có 3 chất tan trong dung dịch NH3

PTHH: \(Fe+H_2SO_{4\left(l\right)}\rightarrow FeSO_4+H_2\uparrow\)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=n_{H_2}=0,1\left(mol\right)\\n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_{Cu}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Cu}+m_{Fe}=0,1\cdot56+0,05\cdot64=8,8\left(g\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{Cu}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
_ Khi pư với H2SO4 loãng.
Theo ĐLBT mol e, có: 2y = 0,1.2 ⇒ y = 0,1 (mol) (1)
_ Khi pư với H2SO4 đặc nóng.
Ta có: \(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo ĐLBT mol e, có: 2x + 3y = 0,2.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,05\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
⇒ m = mCu + mFe = 0,05.64 + 0,1.56 = 8,8 (g)
Bạn tham khảo nhé!

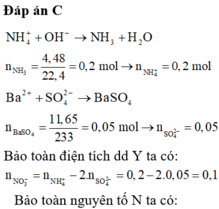


Giả sử ở 2 phản ứng, có 1 mol khí thoát ra.
- TN1:
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\Rightarrow n_{FeSO4}=1\left(mol\right)\)
\(\Rightarrow m_1=152\left(g\right)\)
- TN2:
\(2Fe+6H_2SO_4\rightarrow2Fe_2\left(SO_4\right)_3+3SO_2+3H_2O\)
\(\Rightarrow n_{Fe2\left(SO4\right)3}=\frac{1}{3}\left(mol\right)\)
\(\Rightarrow m_2=133,3\left(g\right)\)
Vậy m1 > m2