Câu 2. Cho 69,6 gam MnO2 tác dụng với HCl đặc, dư. Dẫn toàn bộ lượng khí sinh ra vào 500 ml dung dịch NaOH 4M. Coi thể tích dung dịch thay đổi không đáng kể, nồng độ mol các chất trong dung dịch sau phản ứng là bao nhiêu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
![]() = 0,8 mol
= 0,8 mol
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,8 → ![]() = 0,72 (mol)
= 0,72 (mol)
Vkhí = 0,72.22,4 = 16,128 (lit)
nNaOH = 2 (mol)
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,72 2 → 0,72 0,72 (mol)
do NaOH dư, tính theo Cl2
Dung dịch sau phản ứng: nNaCl = nNaClO = 0,72 (mol)
nNaOH dư = 0,56 (mol)
CNaCl = CNaClO = 1,44M, CNaOH = 1,12M

\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
nKOH = 0,5.4 = 2(mol)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,8------------------------>0,8
2KOH + Cl2 --> KCl + KClO + H2O
Xét tỉ lệ \(\dfrac{2}{2}>\dfrac{0,8}{1}\) => KOH dư, Cl2 hết
2KOH + Cl2 --> KCl + KClO + H2O
1,6<--0,8---->0,8---->0,8
=> \(\left\{{}\begin{matrix}n_{KOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{KCl}=0,8\left(mol\right)\\n_{KClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(KOH\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(KCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(KClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)

Bài 6. Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dần khí X vào 500 ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Trả lời:
MnO2+4HCl→MnCl2+Cl2+2H2OnMnO2=nCl2=0,8molCl2+2NaOH→NaCl+NaClO+H2OnNaOHpu=0,5×2=1,6molnNaOHhd=0,5×4=2molnNaOHdu=2−1,6=0,4molnNaCl=nCl2=nNaClO=0,8molCNaCl=0,80,5=1,6MVNaClO=0,80,5=1,6MCNaOH=0,40,5=0,8M

a) Phương trình hóa học của phản ứng:
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 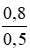
CM (NaOH)dư = 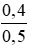
tích cho mình nha![]()

Chọn đáp án A
n M n O 2 = 69 , 6 87 =0,8 (mol); n N a O H = 0,5.4 = 2 (mol)
M n O 2 + 4HCl → M n C l 2 + C l 2 + 2 H 2 O
0,8 0,8 (mol)
C l 2 + 2NaOH → NaCl + NaClO + H 2 O
0,8 1,6 0,8 (mol)
C M N a C l = 0 , 8 0 , 5 = 1,6(M); C M ( N a O H d ư ) = 2 - 1 ; 6 0 ; 5 = 0,8(M)

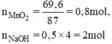
a) Phương trình hóa học của phản ứng:
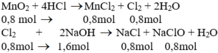
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 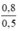 = 1,6 mol/ lit
= 1,6 mol/ lit
CM (NaOH)dư = 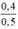 = 0,8 mol/ lit
= 0,8 mol/ lit

nMnO2=69,6/87=0,8 mol
MnO2 +4 HCl =>MnCl2 +Cl2 +2H2O
0,8 mol =>0,8 mol
khí X là Cl2
VCl2=0,8.22,4=17,92 lit
nNaOHbđ=0,5.4=2 mol
Cl2 +2NaOH =>NaCl +NaClO +H2O
0,8 mol=>1,6 mol=>0,8 mol=>0,8 mol
dư 0,4 mol
CM dd NaOH dư=0,4/0,5=0,8M
CM dd NaCl=CM dd NaClO=0,8/0,5=1,6M
0,8 mol


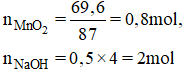
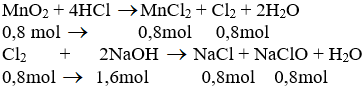
nMnO2=0,8 mol
MnO2 +4HCl-->MnCl2 + Cl2 +2H2O
mol 0,8 0,8
nNaOH=4×0,5= 1mol
Cl2 + 2NaOH --> NaCl + NaClO + H2O
=> Cl2 dư
nNaCl=nNaClO=1\2nNaOH=0,5mol
=> CMNaCl và NaClO =0,5\0,5=1M