Cho 69,6g MnO2 tác dụng với HCl đặc dư thu được một khí X. Dẫn X vào 500ml dd NaOH 4M (D = 1,25g/ml). Thu được dd A. Tính nồng độ phần trăm các chất có trong dd A. Cho rằng thể tích dd thay đổi không đáng kể. Tính nồng độ mol các chất trong dd A??
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Phương trình hóa học của phản ứng:
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 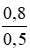
CM (NaOH)dư = 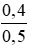
tích cho mình nha![]()

\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
nKOH = 0,5.4 = 2(mol)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,8------------------------>0,8
2KOH + Cl2 --> KCl + KClO + H2O
Xét tỉ lệ \(\dfrac{2}{2}>\dfrac{0,8}{1}\) => KOH dư, Cl2 hết
2KOH + Cl2 --> KCl + KClO + H2O
1,6<--0,8---->0,8---->0,8
=> \(\left\{{}\begin{matrix}n_{KOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{KCl}=0,8\left(mol\right)\\n_{KClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(KOH\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(KCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(KClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)

1.
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
x_____2x_____________x
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
y_____3y_____________1,5y
\(n_{H2}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
Gọi x, y lần lượt là nMg và nAl, ta có:
\(\left\{{}\begin{matrix}24x+27y=10,2\\x+1,5y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
Bạn tự tính % nhé.
\(n_{HCl}=2x+3y=1\left(mol\right)\)
\(\Rightarrow CM_{HCl}=\frac{1}{0,5}=2M\)
2.
Đổi 500 ml = 0,5l
\(n_{NaOH}=0,5.4=2\left(mol\right)\)
\(n_{MnO2}=\frac{69,6}{87}=0,8\left(mol\right)\)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\left(1\right)\)
\(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\left(2\right)\)
Theo (1) nCl2 = nMnO2 = 0,8(mol)
Lập tỉ lệ \(\Rightarrow\) NaOH dư
Theo (2) nNaOH(pư) = 2nCl2 = 1,6(mol)
\(\Leftrightarrow n_{NaOH_{dư}}=2-1,6=0,4\left(mol\right)\)
Theo (2) nNaCl = nCl2 = 0,8(mol)
\(\Rightarrow CM_{NaCl}=\frac{0,8}{0,5}=1,6M\)
\(CM_{NaOH.dư}=\frac{0,4}{0,5}=0,8M\)
3.\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
\(m_{dd_{HCl}}=100,84.1,19=120\left(g\right)\)
\(n_{HCl}=\frac{120.36,5}{36,5}=1,2\left(mol\right)\)
\(n_{H2}=\frac{8,96}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow n_{HCl\left(1\right)}=0,4.2=0,8\left(mol\right);n_{HCl\left(2\right)}=1,2-0,8=0,4\left(mol\right)\)
\(n_{ZnO}=0,2\left(mol\right)\)
\(m_{Zn}=0,4.65=26\left(g\right)\)
\(m_{ZnO}=0,2.81=16,2\left(g\right)\)

3)Phương trình hóa học của phản ứng:
Cl2 + 2NaI → 2NaCl + I2
71g (2 x 127)g
X g 12,7g
X = 3,55g
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
(4 x 36,5g) 71g
Y g 3,55 g
Y = 7,3g
Khối lượng HCl cần dùng là 7,3g
1)
nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol. 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = CM(MnCl2) = CM(NaClO) = 0,8 /0,5 = 1,6 mol/l
CM(NaOH)dư = (2. 1,6)/0,5 = 0,8 mol/l

a, \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{HCl}=0,2.2=0,4\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,4}{2}\), ta được HCl dư.
Theo PT: \(n_{H_2}=n_{Fe}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)=3360\left(ml\right)\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{FeCl_2}=n_{Fe}=0,15\left(mol\right)\\n_{HCl\left(pư\right)}=2n_{Fe}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(dư\right)}=0,4-0,3=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{FeCl_2}}=\dfrac{0,15}{0,2}=0,75\left(M\right)\\C_{M_{HCl\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\end{matrix}\right.\)
c, Ta có: \(m_{ddHCl}=1,25.200=250\left(g\right)\)
⇒ m dd sau pư = 8,4 + 250 - 0,15.2 = 258,1 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{0,15.127}{258,1}.100\%\approx7,38\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,1.36,5}{258.1}.100\%\approx1,41\%\end{matrix}\right.\)

Đáp án C
![]() = 0,8 mol
= 0,8 mol
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,8 → ![]() = 0,72 (mol)
= 0,72 (mol)
Vkhí = 0,72.22,4 = 16,128 (lit)
nNaOH = 2 (mol)
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,72 2 → 0,72 0,72 (mol)
do NaOH dư, tính theo Cl2
Dung dịch sau phản ứng: nNaCl = nNaClO = 0,72 (mol)
nNaOH dư = 0,56 (mol)
CNaCl = CNaClO = 1,44M, CNaOH = 1,12M
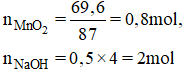
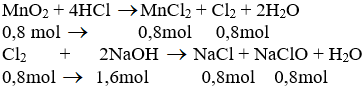
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+H_2O\)
Ta có:
\(n_{MnO2}=\frac{69,2}{55+16.2}=0,8\left(mol\right)\)
Theo phản ứng: \(n_{Cl2}=n_{MnO2}=0,8\left(mol\right)\)
Ta có: \(n_{NaOH}=0,5.4=2\left(mol\right)\)
\(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
Vì \(n_{NaOH}>2n_{Cl2}\Rightarrow\) NaOH dư
\(n_{NaCl}=n_{NaClO}=n_{Cl2}=0,8\left(mol\right)\)
\(n_{NaOH_{Dư}}=2-0,8.2=0,4\left(mol\right)\)
V dung dịch = 500ml = 0,5 lít
\(CM_{NaCl}=CM_{NaClO}=\frac{0,8}{0,5}=1,6M\)
\(CM_{NaOH_{Dư}}=\frac{0,4}{0,5}=0,8M\)
Hong có tính nồng độ phần trăm ạ??