Cho 12g hỗn hợp : Fe&Cu 400ml dd HCl vừa đủ sau p/ứ thu đc 2,24(l)khí H2 (đktc) . Tính thành phần % theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


vì đề không nói là H2SO4 đặc nóng nên mình coi là đặc nguội nha. H2SO4 đặc nguội thụ động với Fe nên không xảy ra phản ứng.

nH2=0,1(mol)
nCl2=0,25(mol)
Gọi a, b là số mol Fe và M.
- TN2:
2Fe+3Cl2→2FeCl32Fe+3Cl2→2FeCl3
M+Cl2→MCl2+H2M+Cl2→MCl2+H2
⇒1,5a+b=0,25⇒1,5a+b=0,25 (1)
- TN1:
+ Nếu M>H:
Fe+2HCl→FeCl2+H2Fe+2HCl→FeCl2+H2
M+2HCl→MCl2+H2M+2HCl→MCl2+H2
⇒a+b=0,1⇒a+b=0,1 (2)
(1)(2)⇒a=0,3;b=−0,2⇒a=0,3;b=−0,2 (loại)
+ Nếu M<H:
⇒a=0,1⇒a=0,1 (3)
(1)(3)⇒b=0,1⇒b=0,1
mhh=12g⇒56.0,1+0,1M=12mhh=12g⇒56.0,1+0,1M=12
⇔M=64(Cu)

gọi a, là số mol của Mg và Fe
PTHH: 2Mg+O2=>2MgO
a------a/2------>a
2Fe+O2=>2FeO
b--------b/2----->b
theo đề ta có hpt: \(\begin{cases}40a+68b=12\\24a+56b=8\end{cases}\)
<=>\(\begin{cases}a=\frac{4}{19}\\b=\frac{1}{19}\end{cases}\)
=> V=(4/19+1/19).22,4=5,9ml
mMg=4/19.24=5,1g
=> %Mg=\(\frac{5,1}{8}.100=63,75\%\)
%Fe=100-63,75=36,25%

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Cu}=12-5,6=6,4\left(g\right)\)
Nhận thấy rừng `Cu` không tác dụng với `HCl` nên toàn bộ lượng `H_2` là do `Fe`
\(n_{H_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Fe+2HCl->FeCl_2+H_2\)
tỉ lệ 1 : 2 : 1 : 1
n(mol) 0,1<------------------------------0,1
\(m_{Fe}=n\cdot M=0,1\cdot56=5,6\left(g\right)\\ m_{Cu}=12-5,6=6,4\left(g\right)\)

Fe + H2SO4--> FeSO4 + H2
2Fe+ 6H2SO4 đ,n--> Fe2(SO4)3 + 3SO2 + 6H2O(1)
Cu + 2H2SO4 đ, n --> CuSO4 + 2H2O + SO2(2)
Ta có nH2=2,24/22,4=0,1 mol
=> nFe=0,1 mol
=> mCu=12-5,6=6,4 g
=> nCu=6,4/64= 0, 1mol
Theo PTHH ta có nSO2 (1)=3.nFe/2=0,15 mol
nSO2(2)=nCu=0,1 mol
=> VSO2=(0,15+0,1).22,4=5,6 lít
Ta có nFe2(SO4)3=nFe/2=0,05 mol
nCuSO4=nCu=0,1 mol
=>m muối=0,05.400+ 160.0,1=36 g

nH2=0,4/2=0,2
a. Fe+H2SO4\(\rightarrow\)FeSO4+H2
nFe=nH2=0,2
\(\rightarrow\)%mFe=\(\frac{0,2.56}{12}\)=93,33%
\(\rightarrow\)%mCu=6,67%
b. \(\text{mCu=12-0,2.56=0,8}\)
Khối lượng ddB: \(\text{m=12+200-mH2-mCu=210,8}\)
a) Fe+H2SO4--->FeSO4+H2
Chất rắn A là Cu, B là FeSO4
n H2=04/2=0,2(mol)
Theo pthh
n Fe=n H2=0,2(mol)
m Fe=56/0,2=11,2(g)
m Cu=12-11,2=0,8(g)
b) m dd B =m Fe+m dd H2SO4-m H2
=11,2+200-0,4=210,8(g)
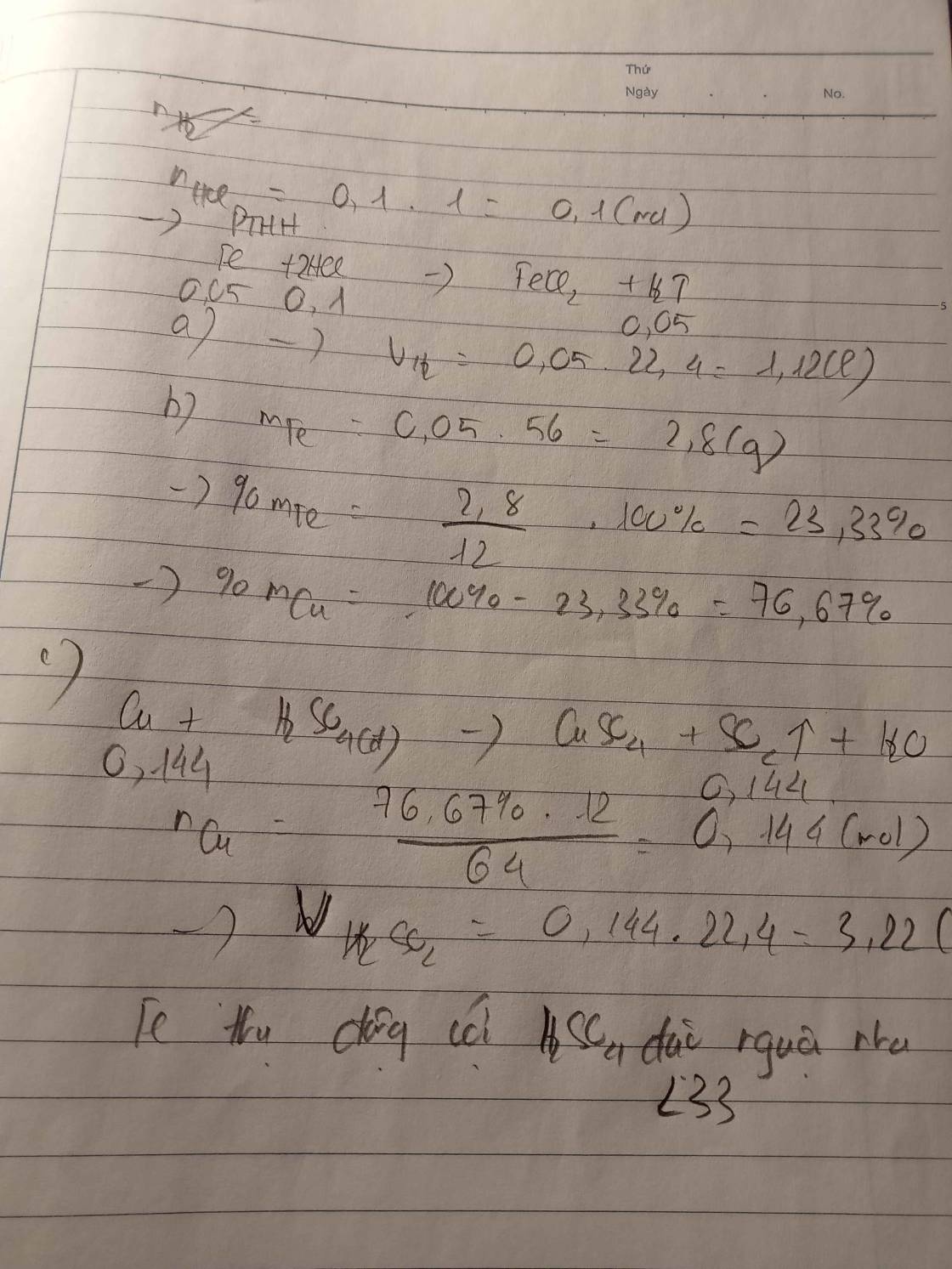
Cu đứng sau H nên Cu không phản ứng được với dung dịch HCl
Fe + 2HCl → FeCl2 + H2
0,1 mol ← 0,1 mol
=> mFe = 0,1.56 = 5,6 gam => mCu = 12 – 5,6 = 6,4 gam
=>%mCu=6,4\12.100=53,3 %
=>%mFe=100-53,3=46,7%