Một hỗn hợp khí X gồm \(N_2\) và \(H_2\) có tỉ khối so với \(H_2\) bằng 3,6. Đun nóng hỗn hợp X một thời gian trong bình kín (có bột Fe làm xúc tác) thu được hỗn hợp khí Y có tỉ khối so với \(H_2\) bằng 4. Tính hiệu suất của phản ứng tổng hợp \(NH_3\). Giả sử rằng khi đun nóng hỗn hợp X chỉ có phản ứng theo sơ đồ:
\(N_2+H_2->NH_3\)

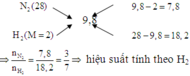
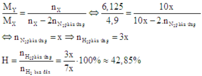
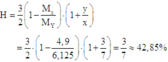
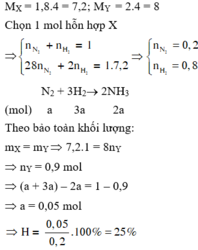


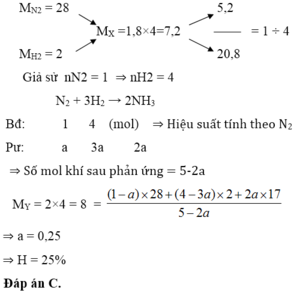
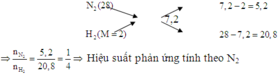



Giả sử x chứa 1 mol N2 và x mol H2
\(n_X=1+x\)
\(m_X=28+2x\)
\(\Rightarrow M_X=\frac{28+2x}{1+x}=3,6.2=7,2\)
\(\Rightarrow x=4\)
Phản ứng xảy ra:
\(N_2+3H_2\rightarrow2NH_3\)
Vì \(n_{H2}>3n_{N2}\) nên hidro dư so với nito.
Hiệu suất tính theo nito.
Gọi số mol nito phản ứng là a, suy hidro phản ứng là 3a.
Sau phản ứng hỗn hợp chứa N2 1-a mol; H2 4-3a mol và NH3 2a mol
Ta có:
\(n_Y=1-a+4-3a+2a=5-2a\)
\(m_X=m_Y=36\Rightarrow M_Y=\frac{36}{5-2a}=4.2=8\Rightarrow a=0,25\)
\(\Rightarrow H=\frac{0,25}{1}.100\%=25\%\)