NHIỆT PHÂN HOÀN TOÀN 19,6G Cu(OH)2 thu đc 1 chất rắn màu đen , dùng khí H2 dư khử chất rắn màu đen đó thu đc chất rắn màu đỏ có khối lượng bn?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
Cu(OH)2 ➝ CuO + H2O (2)
CuO + H2SO4➝ CuSO4 + H2O (1)
Đổi : 100ml= 0,1lít
Số mol axit sunfuric cần dùng là:
n= CM . V = 0,1 . 2=0,2 mol
Từ (1) ➜ nH2SO4= nCuO= 0,2mol
Khối lượng CuO đã nhiệt phân là:
m= n.M= 0,2. 80=16 (g)
Từ (2)➜nCu(OH)2= nCuO=0,2 mol
Khối lượng đồng hiđroxit đã dùng là:
m= n.M = 0,2.98=19,6 (g)
b)
Từ (1)➙ nCuSO4=nCuO= 0.2mol
Khối lượng muối thu được là:
m=n.M= 0,2 . 160=32 (g)
O

Cho m gam kim loại Mg vào dung dịch axit clohidric dư, phản ứng hoàn toàn tạo ra 6,72 lít khí hiđro (đktc). Giá trị của m là (biết Mg=24) *
7,2
3,6.
14,4.
6,72.
Nhiệt phân hoàn toàn 9,8 g Cu(OH)₂ thu được một chất rắn màu đen, dùng khí H₂ dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là (biết Cu=64, O=16, H=1) *
6,4 g
8 g.
12,8 g.
9,8 g.
Chất nào sau đây là muối *
KOH.
HCl.
CuSO4
MgO.
Nhúng 1 thanh kim loại đồng vào 100 ml dung dịch AgNO₃ 0,4 M. Sau khi phản ứng hoàn toàn thu được m gam kim loại bám trên thanh đồng. Giá trị của m là (biết Ag=108, Cu=64, N=14, O=16) *
4,32
21,6.
25,6.
12,8.
Phản ứng nào dưới đây là phản ứng trao đổi trong dung dịch? *
2Na + 2H₂O --> 2NaOH + H₂.
BaO + H₂O --> Ba(OH)₂.
Zn + H₂SO₄ --> ZnSO₄ +H₂.
BaCl2 + H2SO4 ---> BaSO4 + 2HCl
Cho 100ml dung dịch KOH 2M tác dụng với 200ml dung dịch H₂SO₄ 3M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H₂ (đktc) là *
11,2 lít.
8,96 lít.
3,36 lít
6,72 lít
Hình như sai đề
Câu cuối đáp án là 11,2 lít nhé!
Câu kim loại đồng tính như nào ra 4,32 nhỉ?

a, \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
PT: \(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
Theo PT: \(n_{Cu\left(OH\right)_2}=n_{CuO}=0,05\left(mol\right)\)
\(\Rightarrow m_{Cu\left(OH\right)_2}=0,05.98=4,9\left(g\right)\)
b, \(m_{H_2SO_4}=250.9,8\%=24,5\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
PT: \(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,05}{1}< \dfrac{0,25}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{CuSO_4}=n_{H_2SO_4\left(pư\right)}=n_{Cu\left(OH\right)_2}=0,05\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,25-0,05=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{0,05.160}{4,9+250}.100\%\approx3,14\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,2.98}{4,9+250}.100\%\approx7,69\%\end{matrix}\right.\)

a) PTHH: \(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
Ta có: \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)=n_{Cu\left(OH\right)_2}\) \(\Rightarrow m_{Cu\left(OH\right)_2}=0,05\cdot98=4,9\left(g\right)\)
b) PTHH: \(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=0,05\left(mol\right)\\n_{H_2SO_4}=\dfrac{250\cdot9,8\%}{98}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{CuSO_4}=0,05\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{0,05\cdot160}{4,9+250}\cdot100\%\approx3,14\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,2\cdot98}{4,9+250}\cdot100\%\approx7,7\%\end{matrix}\right.\)

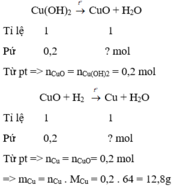
Theo đề ta có : nCu(OH)2 = \(\dfrac{19,6}{98}=0,2\left(mol\right)\)
PTHH :
Cu(OH)2 \(-^{t0}->CuO+H2O\)
0,2mol.....................0,2mol
CuO + H2\(-^{t0}->Cu+H2O\)
0,2mol...................0,2mol
=> mCu = 64.0,2=12,8(g)
Cu(OH)2 ➜ CuO + H2O (1)
CuO + H2 ➜ Cu + H2O (2)
\(n_{Cu\left(OH\right)_2}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
Theo PT1: \(n_{CuO}=n_{Cu\left(OH\right)_2}=0,2\left(mol\right)\)
Số mol CuO ở PT1 chính là số mol CuO ở PT2
Theo PT2: \(n_{Cu}=n_{CuO}=0,2\left(mol\right)\)
⇒ \(m_{Cu}=0,2.64=12,8\left(g\right)\)

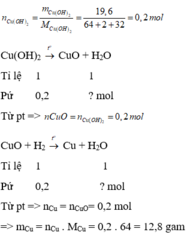
Cu(OH)2-to>CuO+H2O
0,2-------------0,2
CuO+H2-to>Cu+H2O
0,2-----------0,2
nCu(OH)2=19,6\98=0,2 mol
=>mCu=0,2.64=12,8g