Nguyên tử X có tổng số hạt cơ bản là 40. Trong đó tổng số hạt mang điện nhiều hơn số hạt ko mang điện là 12 hạt. Cấu hình electron của nguyên tử X là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


X có cấu hình Electron: \(1s^22s^22p^63s^23p^4\) \(\rightarrow\) X thuộc ô 16, chu kì 3, nhóm VIA
Y có: \(\left\{{}\begin{matrix}p+e+n=40\\p+e-n=12\end{matrix}\right.\) \(\Rightarrow\) \(\left\{{}\begin{matrix}p=e=13\\n=14\end{matrix}\right.\) có cấu hình Electron \(1s^22s^22p^63s^23p^1\) \(\Rightarrow\) Y thuộc ô số 13, chu kì 3, nhóm IIIA
\(Z^{2+}\) có: p = 29 \(\Rightarrow\) p của Z cũng bằng 29 (= e) nên p có cấu hình electron: \(1s^22s^22p^63s^23p^64s^13d^{10}\)
Suy ra Z thuộc ô 29, chu kì 4, nhóm IB.
Chọn câu A.

a, Ta có: P + N + E = 34
Mà: P = E (Do nguyên tử trung hòa về điện.)
⇒ 2P + N = 34 (1)
Theo đề, số hạt mang điện nhiều hơn số hạt không mang điện là 10.
⇒ 2P - N = 10 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}P=E=11=Z\\N=12\end{matrix}\right.\) ⇒ A = 11 + 12 = 23
→ KH: \(^{23}_{11}X\)
b, Cấu hình e: 1s22s22p63s1
Cấu hình e theo orbital:
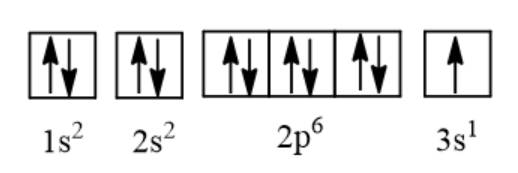
c, X có 1 e hóa trị → tính kim loại
d, - Z = 11 → ô số 11
- Có 3 lớp e → chu kỳ 3
- e cuối cùng phân bố ở phân lớp s, có 1 e hóa trị → nhóm IA
Vậy: X thuộc ô số 11, chu kỳ 3, nhóm IA

Z=(S+a)/4=(40+20)/4=15 suy ra photpho. Photpho có 3 lớp e. Lớp thứ nhất có 2 e, lớp thứ 2 có 8 e, lớp thứ 3 có 5 e.

Một bài tập khá đơn giản, dễ dàng nhận thấy đây là dạng bài toán (2):
+ Gọi số p, n, e trong nguyên tử lần lượt là Z, N, E (nguyên dương)
+ Anion có tổng số hạt cơ bản là 50:
![]()
+ Trong nguyên tử X thì số hạt mang điện nhiều hơn số hạt không mang điện là 16: 2Z - N = 16
Từ đó ta có:
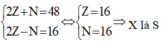
Cấu hình electron của X là: [Ne]3s23p4
Vậy cấu hình electron của S 2 - là [Ne]3s23p4
Đáp án A.

Đáp án A
Theo giả thiết ta có: 2 Z X + 2 Z Y + N X + N Y = 142 ( 2 Z X + 2 Z Y ) - ( N X + N Y ) = 42 ⇔ Z X + Z Y = 46 ( 1 ) N X + N Y = 50 ( 2 )
Mặt khác ta lại có: Tỉ lệ số proton của ion X 2 + và ion Y 3 + là 10 13 ⇒ Z X Z Y = 10 13 ( 3 )
Từ (1) và (3) ta có Z X = 20 ( C a ) v à Z Y = 26 ( F e )
X có cấu hình electron là: 1s22s22p63s23p64s2.
⇒ X có 0 electron độc thân
Fe có cấu hình là 1s22s22p63s23p63d64s2
⇒ F e 3 + có cấu hình là 1s22s22p63s23p63d5
⇒ F e 3 + có 5 electron độc thân
Chú ý: Đây là một bài khá dễ nhưng sẽ có nhiều bạn mắc phải sai lầm đáng tiếc là khi đề cho giả thiết: Tỉ lệ số proton của ion X 2 + và ion Y 3 + là 10 13
Theo quán tính sẽ có rất nhiều bạn sẽ thành lập phương trình sau: Z X - 2 Z Y - 3 = 10 13 dẫn đến không tìm ra kết quả đúng. Ở đây giả thiết cho là proton (hạt mang điện trong hạt nhân) chứ không phải electron (hạt mang điện lớp vỏ). Vì vậy trong quá trình làm bài các bạn nên đọc thật kỹ đề và không nên làm theo quán tính đọc hiểu đề và tư duy ngay cách làm.
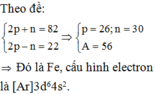




mk hay quên