Trộn 200ml dung dịch hỗn hợp HCl 0,1M và H2SO4 0,05M với 300ml dung dịch Ba(OH)2 a M thu được m (g) kết tủa và 500ml dung dịch ph=13. Tìm a , m .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
nH+ = 0,2.0,1 + 0,2.2.0,05 = 0,04
Sau phản ứng thu được 500ml dung dịch có pH =13 ⇒ nOH- lúc sau = 0,05
⇒ nBa =1/2 nOH- ban đầu = 0,045 ⇒ a = 0,045 ÷ 0,3 = 0,15
nH2SO4 = 0,2.0,05 = 0,01< n Ba = 0,045 ⇒ n↓ = n H2SO4 = 0,01 mol
⇒ m↓ = 2,33g
Đáp án A.

Đáp án C
nBa(OH)2 = 0,2.a mol; nOH-= 0,4a mol
dung dịch H2SO4 có pH = 1 nên [H+] = 10-1 M
→nH+ = [H+].Vdd = 0,3.10-1 = 0,03 mol, nSO4(2-) = 0,015 mol
H2SO4→ 2H++ SO42-
0,03 →0,015 mol
Ba(OH)2→ Ba2++ 2OH-
0,2a→ 0,2a 0,4a
H+ + OH- → H2O
0,4a 0,4a
Dung dịch sau phản ứng có pH = 2 nên axit dư
nH+ dư = 0,03-0,4a
[H+] dư = nH+ dư/ Vdd = (0,03-0,4a)/0,5 = 10-2 suy ra a = 0,0625 M
Ba2++ SO42- → BaSO4
0,0125 0,015 0,0125 mol
mBaSO4 = 2,9125 gam

K+H2O -> KOH+1/2H2
kết tủa lớn nhất <=> nOH-=3nAl3+
Đặt nK=x
Ta có : nOH-=x+0,09 ; nH+=0,01 ; nAl3+=0,04
=> x+0,09=0,02+0,04.3=>x=0,05
=>m=0,05.39=1,95g => đáp án C

`100mL=0,1L`
`n_{H^+}=0,1.0,05.2+0,1.0,1=0,02(mol)`
`n_{SO_4^{2-}}=0,1.0,05=0,005(mol)`
`n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04(mol)`
`n_{Ba^{2+}}=0,1.0,1=0,01(mol)`
`Ba^{2+}+SO_4^{2-}->BaSO_4`
Do `0,01>0,005->` Tính theo `SO_4^{2-}`
`n_{BaSO_4}=n_{SO_4^{2-}}=0,005(mol)`
`->m_↓=0,005.233=1,165(g)`
`H^{+}+OH^{-}->H_2O`
Do `0,02<0,04->OH^-` dư
`n_{OH^{-}\ pu}=n_{H^+}=0,02(mol)`
`->n_{OH^{-}\ du}=0,04-0,02=0,02(mol)`
Trong X: `[OH^-]={0,02}/{0,1+0,1}=0,1M`
`->pH=14-pOH=14+lg[OH^-]=13`

Để Y có khối lượng lớn nhất thì
n O H - = n H + + 3 n A l 3 + = 0 , 14 m o l
⇔ m = 1 , 95 k g
=> Chọn đáp án A.

a, \(n_{HCl}=0,2.0,1=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,2.0,15=0,03\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{H^+}=0,02+0,06=0,08\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,3.0,05=0,015\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,03___0,03 (mol) ⇒ nH+ dư = 0,05 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,015___0,015______0,015 (mol) ⇒ nSO42- dư = 0,015 (mol)
⇒ m = mBaSO4 = 0,015.233 = 3,495 (g)
\(\left[Cl^-\right]=\dfrac{0,02}{0,2+0,3}=0,04\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0,015}{0,2+0,3}=0,03\left(M\right)\)
b, pH = -log[H+] = 1


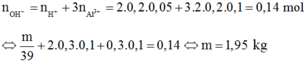
a=0,12
m=2,33g