Đốt cháy hoàn toàn một kim loại A có khối lượng 4,05 gam trong bình chứa oxi dư, sau phản ứng thu được 7,56 gam oxit của kim loại A. Hòa tan hoàn toàn lượng oxit trên bằng dung dịch HCl 20%, khối lượng dung dịch axit HCl đã dùng là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 2:
\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\ n_{Fe}=n_{H_2}=0,45\left(mol\right);n_{HCl}=2.0,45=0,9\left(mol\right)\\ a,m_{Fe}=0,45.56=25,2\left(g\right)\\ b,C_{MddHCl}=\dfrac{0,9}{0,15}=6\left(M\right)\)

Đáp án B
Chỉ xét kim loại trước H, nếu ko được, chọn Cu
Nhận xét: theo bảo toàn e: 2a + nb = 0,05.2 = 0,1
3a + mb = 0,045.4= 0,18 mol →như vậy m > 3 đoán ra Sn
56 a + 119 b = 4 , 69 a + b = 0 , 05 → a = 0 , 02 b = 0 , 03
%mM= 0,03.119/4,69 = 76,12%

a, \(n_{Na}=\dfrac{3,45}{23}=0,15\left(mol\right)\)
PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Theo PT: \(n_{NaOH}=n_{Na}=0,15\left(mol\right)\Rightarrow C_{M_{NaOH}}=\dfrac{0,15}{0,2}=0,75\left(M\right)\)
b, \(n_{H_2}=\dfrac{1}{2}n_{Na}=0,075\left(mol\right)\)
\(n_{O_2}=\dfrac{0,96}{32}=0,03\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,075}{2}>\dfrac{0,03}{1}\), ta được H2 dư.
Theo PT: \(n_{H_2O}=2n_{O_2}=0,06\left(mol\right)\Rightarrow m_{H_2O}=0,06.18=1,08\left(g\right)\)

TN1: Gọi CTHH của oxit là Y2On
\(n_Y=\dfrac{m}{M_Y}\left(mol\right)\)
=> \(n_{Y_2O_n}=\dfrac{m}{2.M_Y}\left(mol\right)\)
=> \(\dfrac{m}{2.M_Y}\left(2.M_Y+16n\right)=1,381m\)
=> \(M_Y=21n\left(g/mol\right)\)
Xét n = 1 => L
Xét n = 2 => L
Xét n = 3 => L
Xét n = \(\dfrac{8}{3}\) => MY = 56 (Fe)
TN2:
\(m_{FeCl_2}=\dfrac{100.15,24}{100}=15,24\left(g\right)\)
=> \(n_{FeCl_2}=\dfrac{15,24}{127}=0,12\left(mol\right)\)
Bảo toàn Fe: nFe = 0,12 (mol)
=> m = mFe = 0,12.56 = 6,72 (g)
PTHH: Fe + 2HCl --> FeCl2 + H2
=> nH2 = 0,12 (mol)
=> V = 0,12.22,4 = 2,688 (l)
nHCl = 0,24 (mol)
=> mHCl = 0,24.36,5 = 8,76 (g)
mdd HCl = 100 + 0,12.2 - 6,72 = 93,52 (g)
\(C\%_{ddHCl}=\dfrac{8,76}{93,52}.100\%=9,367\%\)

Gọi \(n_X=a\left(mol\right)\)
\(4X+nO_2\underrightarrow{t^o}2X_2O_n\)
a \(\dfrac{a}{2}\)
Theo phương trình:
\(a=\dfrac{2\cdot22,95}{2X+16n}=\dfrac{12,15}{X}\)
\(\Rightarrow X=9n\)
Ta có bảng:
| n | 1 | 2 | 3 |
| X | 9 | 18 | 27 |
Vậy X là kim loại Al

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


a/ Gọi x và y là số mol của Cu và Mg ban đầu.
Ta có: 64x + 24y = 7.6 g
<=> 8x + 3y = 0.95 (1)
2Cu + O2 ---------------> 2CuO
x ------------------------------ x mol
2Mg + O2 ---------------> 2MgO
y ------------------------------ y mol
Từ 2 ptpứ ta có KL hỗn hợp sau pứ là: m = 80x + 40y
Vì KL MgO chiếm 20% KL hỗn hợp nên:
\(\dfrac{40y}{80x+40y}\) = 20% = 0.2
<=> 40y = 0.2(80x + 40y)
<=> 40y = 16x + 8y
<=> 32y = 16x
<=> x = 2y. Thế vào (1) ta có:
<=>8.2y + 3y = 0.95
<=> 19y =0.95
<=> y = 0.05 mol.
===> x = 2.0.05 = 0.1 mol.
Vậy khối lượng Mg: m = 0.05.24 = 1.2 g
mCu: m = 7.6 - 1.2 = 6.4 g.
b/
2HCl `+ `CuO -------> CuCl2 + H2O
0.2 <--- 0.1 mol
2HCl ` + `MgO ------> MgCl2 + H2O
0.2 <----- 0.1 mol
Từ 2 pt trên ta tính lượng axit HCl nguyên chất cần dùng: n = 0.2 + 0.2 = 0.4 mol.
=>VHCl=\(\dfrac{0,4}{0,5}\)=0,8l=800ml
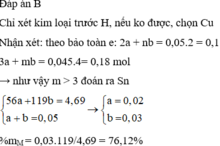

PTHH tổng quát đầu tiên: \(4A+xO_2\rightarrow^{t^o}2A_2O_x\left(x\text{là mol của }A\right)\)
Từ đề bài cho và lý thuết ta thiết lập được:
\(\frac{4,05}{4M}=\frac{7,65}{2\left(2M+16x\right)}\)
\(\Leftrightarrow7,65.4M=4,05.[2\left(2M+16x\right)]\)
\(\Leftrightarrow30,6M=4,05\left(4M+32x\right)\)
\(\Leftrightarrow30,6M=16,2M+129,6x\)
\(\Leftrightarrow30,6M-16,2M=129,6x\)
\(\Leftrightarrow M=9x\)
Lập bảng biện luận chạy từ 1 cho đến 3:
Ta thấy: X phù hợp với giá trị X=3 vì bây giờ M=27 thì nhôm sẽ là Al
Ta có hai phương trình hoá học:
PTHH 1: \(4Al+3O_2\rightarrow^{t^o}2Al_2O_3\)
PTHH 2: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
Ta có \(nAl2O3=\frac{m}{M}=\frac{7,65}{102}=0,075mol\)
Dựa vào PTHH 2: \(nHCl=0,075.6=0,45mol\)
\(mHCl=0,45.36,5=16,425g\)
\(\rightarrow m_{ddHCl}=\frac{16,425.100}{20}=82,125g\)