Nguyên tử nguyên tố X có tổng số hạt (proton, nơtron, electron) là 115, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Cấu hình electron lớp ngoài cùng của X là
A. 4 s 2
B. 4 s 2 4 p 5
C. 3 s 2 3 p 5
D. 3 d 10 4 s 1
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
Ta có:p+e+n=116
Tức là :2p+n=116 (pt 1)
Số hạt mang điện trong ng tử là p và nên ta có p+e =2p
Số hạt không mang điện là n
Nên ta có 2p -n=24(pt2)
Từ 1,2 suy ra 2p+n=16
2p -n =24
Giải ra ta được:p=35,n=46
Số khối A=p+n =35+46=81
Ta có kí hiệu ngtu 81x35(xin lỗi mik ko ghi được)

Ta có: P + N + E = 24
Mà: P = E (do nguyên tử trung hòa về điện)
⇒ 2P + N = 24 (1)
- Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 8.
⇒ 2P - N = 8 (2)
Từ (1) và (2) ⇒ P = E = N = 8
Cấu hình e: 1s22s22p4
→ Số e lớp ngoài cùng là 6.
Đáp án: A
Đây là nguyên tử oxygen nên số lớp electron ngoài cùng là 6
Chọn: A

cảm ơn bạn nhiều nhé !
nhưng mà cõ chỗ mình vẫn chưa hiểu . 2p + n = 24
2p - n = 8 ( sao hai cái này tính ra p và n = 8 được vậy bạn )

Ta có: \(\left\{{}\begin{matrix}p+e+n=115\\p=e\\p+e-n=25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=35\\n=45\end{matrix}\right.\)

Với dạng bài toán này thì ta có thể giải theo 2 cách:
Cách 1:
Áp dụng công thức:
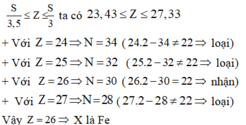
Cách 2: Gọi số p, n, e trong nguyên tử lần lượt là Z, N, E (nguyên dương)
+ Nguyên tử của nguyên tố X có tổng số hạt cơ bản (proton, nơtron, electron) là 82 hạt: 2Z + N = 82
+ Hạt mang điện nhiều hơn hạt không mang điện là 22 hạt: 2Z - N = 22
Từ đó ta có:
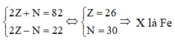
Đáp án A.

Ta có: \(\left\{{}\begin{matrix}2p+n=115\\2p-n=25\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}p=e=35\\n=45\end{matrix}\right.\)
B
Gọi số proton, nơtron và electron của X là p, n và e (trong đó p = e)
Theo bài ra ta có hệ phương trình:
=> Cấu hình nguyên tử của X là