Câu 11: Nhiệt phân hoàn toàn 30,3 gam hỗn hợp 2 bazơ không tan Cu(OH)2 và Fe(OH)3, sau pư thu được 24 gam 2 oxit.
a) Tính % số mol mỗi bazơ trong hỗn hợp đầu?
b) Cho 2 oxit trên pư vừa đủ với 200 ml dung dịch HCl xM. Tìm x?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a
PTHH:
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
\(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
b
Gọi \(\left\{{}\begin{matrix}n_{Al\left(OH\right)_3}=x\left(mol\right)\\n_{Fe\left(OH\right)_3}=y\left(mol\right)\end{matrix}\right.\)
Theo PTHH suy ra: \(\left\{{}\begin{matrix}n_{Al_2O_3}=0,5x\left(mol\right)\\n_{Fe_2O_3}=0,5y\left(mol\right)\end{matrix}\right.\)
Theo đề có hệ phương trình: \(\left\{{}\begin{matrix}78x+107y=29,2\\102.0,5x+160.0,5y=21,1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al\left(OH\right)_3}=\dfrac{78.0,1.100\%\%}{29,2}=26,71\%\\\%m_{Fe\left(OH\right)_3}=\dfrac{107.0,2.100\%}{29,2}=73,29\%\end{matrix}\right.\)

Đáp án A
Các phản ứng xảy ra trong quá trình nhiệt phân:
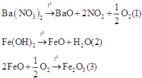
Do đó hỗn hợp khí và hơi thu được gồm NO2, O2 và H2O. Sau khi làm lạnh hỗn hợp khí và hơi thì hỗn hợp khí thu được gồm NO2 và O2.


Gọi số mol H2O sinh ra là a (mol)
=> \(n_{H_2SO_4}=a\left(mol\right)\)
Theo ĐLBTKL: moxit + mH2SO4 = mmuối + mH2O
=> 16,6 + 98a = 24,6 + 18a
=> a = 0,1 (mol)
=> nO = 0,1 (mol)
=> mkim loại = 16,6 - 0,1.16 = 15 (g)
\(m_{H_2SO_4}=0,1.98=9,8\left(g\right)\)

2Fe(OH)3 -----to---> Fe2O3 + 3H2O
Mg(OH)2 ----to---> MgO + H2O
Gọi x, y lần lượt là số mol Fe(OH)3 và Mg(OH)2
\(\left\{{}\begin{matrix}107x+58y=16,5\\\dfrac{1}{2}.160x+y.40=12\end{matrix}\right.\)
=> x=0,1 ; y=0,1
\(\%m_{Fe\left(OH\right)_3}=\dfrac{107.0,1}{16,5}.100=64,85\%\)
%Mg(OH)2 = 35,15%
b) \(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+6H_2O\)
0,1----------------------------------->0,05
\(Mg\left(OH\right)_2+H_2SO_4\rightarrow MgSO_4+2H_2O\)
0,1------------------------------------>0,1
\(m_{ddsaupu}=16,5+200=216,5\left(g\right)\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,05.400}{216,5}.100=9,24\%\)
\(C\%_{MgSO_4}=\dfrac{0,1.12}{216,5}.100=5,54\%\)