Cho hỗn hợp X gồm 0,56 gam Fe và 0,12 gam Mg tác dụng với 250 ml dung dịch C u S O 4 . Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,92 gam kim loại. Nồng độ mol/l của dung dịch CuSO4 là:
A. 0,02M
B. 0,04M
C. 0,05M
D. 0,1M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án B
nFe = 0,01; nMg = 0,005
Δm = 0,92 – 0,56 – 0,12 = 0,24
Mg + Cu2+ → Mg2+ + Cu
0,005 → 0,005 → 0,005
=> Δm1 = 0,005(64 – 24) = 0,2 => Δm2 = 0,24 – 0,2 = 0,04
Fe + Cu2+ → Fe2+ + Cu
x x x
=> (64 – 56)x = 0,04 => x = 0,005
Vậy nCuSO4 = 0,005 + 0,005 = 0,01 => CM = 0,01/0,25 = 0,04M

Định hướng tư duy giải
Tư duy đi tắt đòn đầu
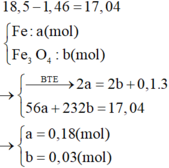
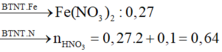
=> [HNO3] = 3,2 (M)

Đáp án A
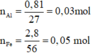
Sau phản ứng thu được 3 kim loại => Fe còn dư; Al, AgNO3 và Cu(NO3)2 đều phản ứng hết; 3 kim loại thu được gồm Ag, Cu và Fe dư.
![]()
Đặt số mol của AgNO3 và Cu(NO3)2 lần lượt là a, b
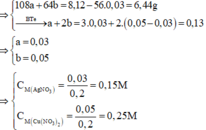

Đáp án A
Phương trình hóa học:
Mg + CuSO4 → MgSO4 + Cu (1)
Fe + CuSO4 → FeSO4 + Cu (2)
Có: nMg = 0,01 mol và nFe = 0,02 mol
Theo (1) và (2), nếu Mg và Fe phản ứng hết thì thu được 0,03 mol Cu.
Khối lượng kim loại thu được sau phản ứng là:
0,03 .64 = 1,92 (gam)
Thực tế chỉ thu được 1,88 gam kim loại. Chứng tỏ kim loại đã cho không phản ứng hết.
Mg có tính khử mạnh hơn Fe nên phản ứng trước.
Lượng Cu sinh ra ở (1) là 0,01 mol tương ứng với khối lượng 0,64 (gam)
Khối lượng Fe dư và Cu sinh ra ở (2) là: 1,88 – 0,64 = 1,24 (gam)
Đặt khối lượng Fe tham gia ở (2) là x, khối lượng sắt dư là (1,12 – 56x) và khối lượng Cu sinh ra ở (2) là 64x.
Ta có: (1,12-56x) + 64x = 1,24 => x = 0,015
Lượng CuSO4 trong 250 ml dung dịch đã phản ứng hết:
0,015 + 0,01 = 0,025(mol)
Nồng độ mol của dung dịch đã dùng là : 0,025/0,25 = 0,1mol/l