Một dung dịch có [ H + ] = 1 , 5 . 10 - 4 M. Môi trường của dung dịch là
A. axit.
B. kiềm.
C. trung tính.
D. không xác định được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Có [OH-] = 10-5
=> pH = 14 - 5 = 9 > 7
=> Môi trường dung dịch là kiềm
=>D

- Đáp án C
- Từ [OH-]= 1,5.10-5 (M) suy ra:
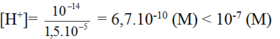
Vậy môi trường của dung dịch là kiềm.

[H+] = 0,010M = 10-2M ⇒ pH = -log[H+] = -log(1,0.10-2) = 2
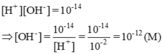
Môi trường của dung dịch này là axit (pH < 7)
Cho quỳ tím vào dung dịch này quỳ sẽ chuyển thành màu đỏ

Mình không chắc lắm, bạn tham khảo thử nhé!
pOH = -log(1,5x10-5) = 4,8
pH = 14 - 4,8 = 9,2 → môi trường của dung dịch là kiềm

\(n_{NaOH}=\dfrac{8}{40}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\)\(mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2 0,2
Dung dịch thu được là \(Na_2SO_4\) có môi trường trung hòa.

[H+] = 0,01M = 10-2M => pH = 2
[OH-] = 10-14 / 10-2M =10-12
Dung dịch có pH = 2 < 7 => môi trường axit, quỳ tím có màu đỏ.

[OH-]=1.10^-14/0.01=10^-12 (M) tính Ph=log[H+] từ kết quả của Ph xem nó lớn hơn 7 hay j xong suy ra môi trường ,môi trường axit thì quỳ đỏ môi trường kiềm quy xanh trung tính ko màu
Chọn A
Có [ H + ] = 1 , 5 . 10 - 4 M > 10 - 7 M Môi trường của dung dịch là môi trường axit