Trong một cốc nước chứa 0,01 mol Na+ ; 0,02 mol Ca2+ ; 0,04 mol Mg2+ ; 0,09 mol HCO3- ; còn lại là Cl- và SO42- . Trong số các chất sau: Na2CO3, BaCO3, NaOH, K3PO4, Ca(OH)2, HCl, số chất có thể làm mềm nước trong cốc là:
A. 2
B. 3
C. 4
D. 5
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Ta thấy cốc nước có chứa các ion Ca2+, Mg2+, HCO3-, Cl- => đây thuộc nước cứng toàn phần
Đáp án B

Đáp án A
- Khi đun sôi: 2HCO3 → CO32- + CO2 + H2O
Mol 0,05 → 0,025
- Ta thấy tổng số mol (Ca2+, Mg2+) > số mol CO32-
=> Trong dung dịch sau khi đun có Ca2+, Mg2+ và Cl-
=> Đây là loại nước cứng vĩnh cửu

Khi đun sôi : 2HCO3- → CO32- + CO2 + H2O
=> n CO32- = 0,025 mol tạo kết tủa với Mg2+ và Ca2+ nhưng ion kim loại này vẫn còn dư => nước trong cốc trở thành nước cứng vĩnh cửu
=>A

Đáp án B
![]() có thể làm mềm nước cứng do tạo tủa trực tiếp
có thể làm mềm nước cứng do tạo tủa trực tiếp
Với ![]()
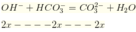
Để làm mềm nước thì kết tủa hoàn toàn ![]()
![]()
![]()
![]()
nên không thể làm mềm nước bằng C a ( O H ) 2

Đáp án C.
Cốc nước trên chứa các ion: Ca2+, Mg2+, HCO3-, Cl-
⇒ Thuộc nước cứng toàn phần (có cả tính cứng tạm thời và tính cứng vĩnh cửu)

Đáp án : B
2HCO3- → CO32- + H2O 0.1 → 0.05 mà nCa2+ + nMg2+ = 0.06
=> CO32- hết Mg2+ và Ca2+Trở thành nước cứng vĩnh cửu
Đáp án B
Để làm mềm nước cứng thì phải làm kết tủa hết các ion Ca2+ và Mg2+ có trong dung dịch.
♦ Dễ thấy Na2CO3 và Na3PO4 là 2 chất thỏa mãn (làm mềm mọi loại nước cứng)
♦ BaCO3: không được vì bản thân chất này đã kết tủa
♦ NaOH: thỏa mãn, vì OH- tác dụng với HCO3- tạo 0,09 mol CO3 2-, (dư để tạo kết tủa hết với Mg2+ và Ca2+)
♦ Ca(OH)2: không thỏa mãn, do cho Ca(OH)2 vào thì lượng CO3 2- sinh ra sẽ kết tủa luôn với lượng Ca2+ cho vào nên vẫn còn Ca2+ và Mg2+ trong dung dịch
♦ HCl:không thỏa mãn, cho HCl vào thì không làm thay đổi ion Ca2+ và Mg2+.