Hòa tan hết cùng 1 lượng Fe trong dd H2SO4 loãng(1) , và H2SO4 đặc nóng (2) thì thể tích khí sinh ra trong cùng điều kiện là
A. A (1) bằng (2)
B. B (1) gấp đôi (2)
C. C (2) gấp rưỡi (1)
D. D (2) gấp ba (1)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Hòa tan hết cùng 1 lượng Fe (x mol) trong dung dịch H2SO4 loãng(1) và H2SO4 đặc, nóng (2):
Fe + H2SO4 → FeSO4 + H2↑
→ VH2 = 22,4x lít.
2Fe + 6H2SO4 đ 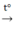 Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
VSO2 = 3/2.x.22,4 = 33,6l
=> Thể tích khí sinh ra trong cùng điều kiện (2) gấp rưỡi (1)

\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.15.................................0.15\)
\(n_{Fe}=1.25\cdot0.15=0.1875\left(mol\right)\)
\(2Fe+6H_2SO_{4\left(đ\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(0.1875..........................................0.28125\)
\(V_{SO_2}=6.3\left(l\right)\)

b) Tính khối lượng H2SO4 dư sau pư, biết H2SO4 đã lấy dư so với lượng pư là 10%

a. Có các phản ứng hóa học xảy ra:
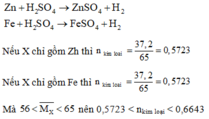
Ta có: n H 2 S O 4 phản ứng = nkim loại < 0,6643
Mà: n H 2 S O 4 ban đầu = 1 > 0,6643 nên sau phản ứng kim loại tan hết, axit còn dư.
b. Khi sử dụng lượng X gấp đôi thì 0,5723.2 < nkim loại < 0,6643.2
Hay 1,1446 < nkim loại < 1,3286
Mà nếu các kim loại bị hòa tan hết thì n H 2 S O 4 phản ứng = nkim loại > 1,1446
Do n H 2 S O 4 thực tế = 1 < 1,1446 nên sau phản ứng kim loại chưa tan hết.
Đán án A
Đ/A :B