Cho dòng khí CO qua hỗn hợp 2 oxit CuO và F e 3 O 4 nung nóng thu được 29,6g hỗn hợp 2 kim loại trong đó sắt nhiều hơn đồng là 4g.
Tính thể tích khí CO cần dùng (đktc).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(m_{Fe}\) + \(m_{Cu}\) = 29,6
hay\(m_{Cu}\) +4 + \(m_{Cu}\) = 29,6
2\(m_{Cu}\) = 25,6
\(m_{Cu}\) =12,8(g)
=> \(m_{Fe}\) = 16,8(g)
Số mol của 12,8 g Cu:
\(\frac{12,8}{64}\)= 0,2(mol)
Số mol của 16,8g Fe:
\(\frac{16,8}{56}\)=0,3(mol)
CO + CuO \(\rightarrow\) Cu + C\(O_2\)
1(mol) 1(mol)
0,2(mol) 0,2(mol)
4CO + \(Fe_3\)\(O_4\) \(\rightarrow\) 3Fe + 4C \(O_2\)
4(mol) 3(mol)
0,4(mol) 0,3(mol)
Thể tích CO cần dùng:
(0,2+0,4).22,4= 13,44(l)
PTHH: Fe3O4+4Co->3Fe+4Co2 (1)
CuO+Co->Cu+Co2 (2)
Lại có: mFe+mCu=29,6
mFe-mCu=4
=>mFe=16,8=> nFe=0.3mol
mCu=12,8g=>nCu=0.2mol
Theo PTHH(1)
nFe:nCo= 3:4=> nCo=0,3.4/3=0,4mol
nCu:nCo= 1:1 => nCo= 0,2mol
=> nCo=0,6mol=13,44(l)

a)
Ca(OH)2 + CO2 --> CaCO3 + H2O
CO + CuO --to--> Cu + CO2
b)
\(n_{CaCO_3}=\dfrac{1}{100}=0,01\left(mol\right)\)
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
0,01<-----0,01
\(n_{CuO}=\dfrac{0,64}{64}=0,01\left(mol\right)\)
PTHH: CO + CuO --to--> Cu + CO2
0,01<--------------0,01
=> Vhh khí = (0,01 + 0,01).22,4 = 0,448 (l)
VCO = 0,01.22,4 = 0,224 (l)
VCO2 = 0,01.22,4 = 0,224 (l)

a)
FeO + H2 --to--> Fe + H2O
CuO + H2 --to--> Cu + H2O
b) \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
0,1<--0,1<-----0,1
=> \(m_{FeO}=12-0,1.80=4\left(g\right)\)
=> \(n_{FeO}=\dfrac{4}{72}=\dfrac{1}{18}\left(mol\right)\)
FeO + H2 --to--> Fe + H2O
\(\dfrac{1}{18}\)-->\(\dfrac{1}{18}\)----->\(\dfrac{1}{18}\)
=> \(V_{H_2}=\left(0,1+\dfrac{1}{18}\right).22,4=\dfrac{784}{225}\left(l\right)\)
c) \(m_{Fe}=\dfrac{1}{18}.56=\dfrac{28}{9}\left(g\right)\)
d) \(\left\{{}\begin{matrix}m_{CuO}=0,1.80=8\left(g\right)\\m_{FeO}=4\left(g\right)\end{matrix}\right.\)

\(n_{Cu}=\dfrac{6,4}{64}=0,1mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,1 0,1 ( mol )
\(\left\{{}\begin{matrix}m_{CuO}=0,1.80=8g\\m_{FeO}=12-8=4g\end{matrix}\right.\)

\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(\Rightarrow m_{Cu}=6-2,8=3,2g\)\(\Rightarrow n_{Cu}=0,05mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,05 0,05
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,075 0,05
\(\Rightarrow\Sigma n_{H_2}=0,075+0,05=0,125mol\)
\(\Rightarrow V=0,125\cdot22,4=2,8l\)

a, PTHH:
Fe2O3 + 3H2 ---to---> 2Fe + 3H2O (1)
CuO + H2 ---to---> Cu + H2O (2)
b, nFe = \(\dfrac{2,8}{56}=0,05\left(mol\right)\)
nCu = \(\dfrac{6-2,8}{64}=0,05\left(mol\right)\)
Theo pt (1): nH2 (1) = 2nFe = 2 . 0,05 = 0,1 (mol)
Theo pt (2): nH2 (2) = nCu = 0,05 (mol)
=> VH2 = (0,1 + 0,05) . 22,4 = 3,36 (l)
c, Theo pt (1): nCuO = nCu = 0,05 (mol)
Theo pt (2): nFe2O3 = \(\dfrac{1}{2}n_{Fe}=\dfrac{1}{2}.0,05=0,025\left(mol\right)\)
=> m = 0,05 . 80 + 0,025 . 160 = 8 (g)
\(a.CuO+H_2-^{t^o}\rightarrow Cu+H_2O\\ Fe_2O_3+3H_2-^{t^o}\rightarrow2Fe+3H_2O\\ b.m_{Cu}=6-2,8=3,2\left(g\right)\\ n_{Cu}=0,05\left(mol\right);n_{Fe}=0,05\left(mol\right)\\ \Sigma n_{H_2}=n_{Cu}+\dfrac{3}{2}n_{Fe}=0,125\left(mol\right)\\ \Rightarrow V_{H_2}=2,8\left(l\right)\\ c.n_{CuO}=n_{Cu}=0,05\left(mol\right);n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,025\left(mol\right)\\ m_{hh}=m_{CuO}+m_{Fe_2O_3}=0,05.80+0,025.160=8g\)

\(n_{CaCO3}=\dfrac{2}{100}=0,02\left(mol\right)\)
Bảo toàn nguyên tố C: \(n_{CO}=n_{CaCO_3}=0,02\left(mol\right)\)
\(n_{Cu}=\dfrac{1,92}{64}=0,03\left(mol\right)\)
CuO + CO -------> Cu + CO2
0,02-------->0,02-->0,02
CuO + H2 -------> Cu + H2O
0,01<--------0,03-0,02=0,01
Phần trăm về thể tích cũng là phần trăm về số mol
=>\(\%V_{H_2}=\dfrac{0,01}{0,01+0,02}.100=33,33\%\)
=> %VCO=100- 33,33=66,67%
\(\%m_{H_2}=\dfrac{2.0,01}{2.0,01+44.0,02}.100=2,22\%\)
%mCO= 100-2,22=97,78%
b) \(V_{CO_2}=0,02.22,4=0,448\left(l\right)\)
PTHH của các phản ứng:
Gọi x là khối lượng của Cu sau phản ứng
→ Khối lượng của sắt sau phản ứng là x+4
Theo đề bài ta có: x + x + 4 = 29,6 → x = 12,8(g)
Theo pt: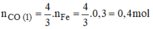
n C O ( 2 ) = n C u = 0 , 2 m o l
n C O = (0,4 + 0,2).22,4 = 13,44(l)