Nhỏ từ từ dung dịch Ba(OH)2 0,4M vào ống nghiệm chứa dung dịch Al2(SO4)3. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau:
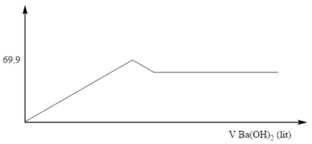
Giá trị của V gần nhất là:
A. 1,10
B. 1,20
C. 0,85
D. 1,25
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
► Tại V lít Ba(OH)2: kết tủa chỉ có BaSO4 ⇒ nBaSO4 = 0,3 mol.
Bảo toàn gốc SO4: nAl2(SO4)3 = 0,1 mol. Do ↓ chỉ có BaSO4 ⇒ Al(OH)3 bị hòa tan hết.
||⇒ nOH– = 4nAl3+ = 0,1 × 2 × 4 = 0,8 mol ⇒ V = 0,8 ÷ 2 ÷ 0,4 = 1M

Đáp án B
► Tại V lít Ba(OH)2: kết tủa chỉ có BaSO4 ⇒ nBaSO4 = 0,3 mol.
Bảo toàn gốc SO4: nAl2(SO4)3 = 0,1 mol. Do ↓ chỉ có BaSO4 ⇒ Al(OH)3 bị hòa tan hết. ⇒ nOH– = 4nAl3+ = 0,1 × 2 × 4 = 0,8 mol ⇒ V = 0,8 ÷ 2 ÷ 0,4 = 1M

Đáp án B
► Tại V lít Ba(OH)2: kết tủa chỉ có BaSO4
⇒ nBaSO4 = 0,3 mol.
Bảo toàn gốc SO4: nAl2(SO4)3 = 0,1 mol.
Do ↓ chỉ có BaSO4 ⇒ Al(OH)3 bị hòa tan hết.
||⇒ nOH– = 4nAl3+ = 0,1 × 2 × 4 = 0,8 mol
⇒ V = 0,8 ÷ 2 ÷ 0,4 = 1M

Chọn đáp án B
Tại V thì kết tủa chỉ chứa BaSO4 với
n B a S O 4 = 69 , 9 233 = 0 , 3 m o l → n A l 2 ( S O 4 ) 3 = n B a S O 4 3 = 0 , 1 m o l ⇒ n B a ( O H ) 2 = 4 n A l 3 + 2 = 8 n A l 2 ( S O 4 ) 3 2 = 0 , 4 m o l ⇒ V B a ( O H ) 2 = 2 l í t

Chọn B.
Các phương trình phản ứng có thể xảy ra là:
B a 2 + + S O 4 2 - → B a S O 4 ( k t ) A l 3 + + O H - → A l ( O H ) 3 A l ( O H ) 3 + O H - → A l ( O H ) 4 -
Tại vị trí thể tích dung dịch Ba(OH)2 thì có kết tủa BaSO4 và dung dịch A l ( O H ) 4 -
n k t = 0 , 3 m o l ⇒ n S O 4 2 - = n k t = 0 , 3 m o l ⇒ n A l 3 + = 0 , 2 m o l ⇒ n O H - = 4 n A l 3 + = 0 , 8 m o l ⇒ n B a ( O H ) 2 = 1 / 2 . n O H - = 0 , 4 m o l ⇒ V = 0 , 4 0 , 2 = 2 l í t

Giải thích:
Giải thích các quá trình biến thiên trong đồ thị:
Đoạn 1: Đi lên, do sự tạo thành BaSO4 và Al(OH)3
Đoạn 2: Đi xuống, do sự hòa tan kết tủa Al(OH)3
Đoạn 3: Đi ngang, do BaSO4 không tan.
Từ đồ thị ta thấy giá trị m = 69,9 gam không đổi khi thể tích Ba(OH)2 thay đổi
=> m↓ = mBaSO4 = 69,9 (gam) => nBaSO4 = 69,9 : 233 = 0,3 (mol)
nAl2(SO4)3 = 1/3 nBaSO4 = 0,1 (mol) => nAl3+ = 2nAl2(SO4)3 = 2. 0,1 = 0,2 (mol)
Theo công thức tính nhanh, xuất hiện kết tủa, sau đó kết tủa tan: nOH- = 4nAl3+ - n↓
=> 0,4V = 4.0,2 – 0
=> V = 2 (lít)
Gần nhất với 2,1 lít
Đáp án B
Giải thích:
Giải thích các quá trình biến thiên trong đồ thị:
Đoạn 1: Đi lên, do sự hình thành BaSO4 và Al(OH)3
Đoạn 2: Đi xuống, do sự hòa tan kết tủa Al(OH)3
Đoạn 3: Đi ngang, do BaSO4 không tan
Từ đồ thị ta có: mBaSO4 = 69,9 gam => nBaSO4 = 0,3 (mol) => nAl2(SO4)3 = 0,1 (mol) => nAl3+ = 0,2 (mol)
Theo công thức, xuất hiện kết tủa Al(OH)3 sau đó kết tủa tan: nOH- = 4nAl3+ - n↓
=> 0, 8 V = 4. 0,2 -0
=> V = 1 (lít) => gần nhất với Đáp án A là 1,1 lít
Đáp án A