Xenlulozơ trinitrat là chất dễ cháy và nổ mạnh được điều chế từ xenlulozơ và HNO3. Muốn điều chế 29,7 kg Xenlulozơ trinitrat (hiệu suất 90%) thì thể tích HNO3 96%( d=1,52 g/ml) cần dùng là
A. 1,439 lít.
B. 14,39 lít.
C. 24,39 lít.
D. 15 lít.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
C6H7O2(OH)3 + 3HNO3 → C6H7(NO2)3 + 3H2O.
3.63 297
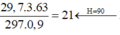 29,7
29,7
H=96% →m(dd HNO3) = 21 0 , 96 = 21,875 kg
V(dd HNO3) = 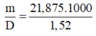 = 14391 ml = 14,391 lít
= 14391 ml = 14,391 lít

Đáp án D
C6H7O2(OH)3 + 3HNO3 → C6H7(NO2)3 + 3H2O.
3.63 297
29 , 7 . 3 . 63 297 . 0 , 9 = 21 ← H = 90 29 , 7
H=96% → m d d H N O 3 = 21 0 , 96 = 21 , 875 k g
V d d H N O 3 = m D = 21 , 875 . 1000 1 , 52 = 14391 m l = 14 , 391 l í t

Đáp án C
+ Phản ứng điều chế xenlulozơ trinitrat:
- C 6 H 7 O 2 ( O H ) 3 - + 3 H N O 3 → - C 6 H 7 O 2 ( O N O 2 ) 3 - + 3 H 2 O k g : 3 . 63 → 297 k g : 1 , 52 V . 67 % . 90 % → 14 , 85
Suy ra: V=10.31 lít
Đáp án B
n C6H7O2(NO3)3 = 0,1 k.mol => n HNO3 = 0,3 k.mol
=> n lý thuyết = 0,3 : 90 . 100 = k.mol => m HNO3 = 21 g
=> m dd HNO3 = 21 : 96 . 100 = 21,875 k.g
=> V dd HNO3 = 21,875 : 1,52 = 14,39 k.ml = 14,39 lít