Cho 16,8 gam sắt tác dụng với dung dịch H2SO4 loãng dư thu được V lít khí H2 đktc. Giá trị của V là
A. 13,44
B. 10,08
C. 4,48
D. 6,72
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Cứ 278 g FeSO4.7H2O có 152 g FeSO4
→ 55,6 g FeSO4.7H2O có x (g) FeSO4
Khối lượng FeSO4 là 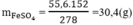
Số mol FeSO4: 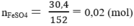
Fe + H2SO4 → FeSO4 + H2
nH2 = nFeSO4 = 0,2 (mol) ⇒ VH2 = 0,2.22,4 = 4,48 (lit)

PTHH: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)=n_{Fe}\)
\(\Rightarrow n_{Fe_2O_3}=0,15\left(mol\right)\) \(\Rightarrow m_{Fe_2O_3}=x=0,15\cdot160=24\left(g\right)\)

\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1---->0,3
Zn + H2SO4 --> ZnSO4 + H2
0,3<--------------------0,3
=> m = 0,3.65 = 19,5 (g)
Chọn đáp án D
Ta có: ne=0,3
=>nH2=0,3
=>V=6,72(l)