Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với hỗn hợp gồm 4,8 gam magie và 8,1 gam nhôm tạo ra 37,05 gam hỗn hợp các muối clorua và oxit của 2 kim loại. Tính số mol clo và oxi trong A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A

Gọi số mol các chất trong A là Cl2 : a mol ; O2 : b mol
Sơ đồ phản ứng:

Tổ hợp (1) và (2) ta được : a = 0,25 mol ; b = 0,2 mol
Phần trăm khối lượng Cl2 trong A là:
![]()

$n_{Mg} = \dfrac{4,8}{24} = 0,2(mol)$
$n_{Al} = \dfrac{8,1}{27} = 0,3(mol)$
Gọi $n_{Cl_2} = a(mol) ; n_{O_2} = b(mol)$
Ta có :
Bảo toàn khối lượng $\to 4,8 + 8,1 + 71a + 32b = 37,05$
Bảo toàn electron $0,2.2 + 0,3.3 = 2a + 4b$
Suy ra : a = 0,25 ; b = 0,2
$\%V_{Cl_2} = \dfrac{0,25}{0,25 + 0,2}.100\% = 55,56\%$

Chọn C. Đặt nCl2=x mol và nO2=y mol. Phản ứng vừa đủ tạo muối gồm các ion sau: Al3+, Mg2+ , Cl- , O2-.
Theo định luât bảo toàn điện tích: 3nAl3+ +2nMg2+ = nCl- + 2nO2- = 2nCl2 + 4nO2
mmuối= 27nAl3+ +24nMg2+ + 35,5nCl- + 16nO2-
→ Hệ
3 . 0 , 2 + 2 . 0 , 1 = 2 x + 4 y 27 . 0 , 2 + 24 . 0 , 1 + 71 x + 32 y = 25 , 2 → x = 0 , 2 y = 0 , 1

n Mg = 3,6/24 = 0,15(mol)
n Al = 5,4/27 = 0,2(mol)
Gọi n Cl2 = a(mol) ; n O2 = b(mol)
Bảo toàn e :
2n Cl2 + 4n O2 = 2n Mg + 3n Al
<=> 2a + 4b = 0,15.2 + 0,2.3 = 0,9(1)
Bảo toàn khối lượng :
m X + m Al + m Mg = m Z
=> 71a + 32b = 29,95 - 3,6 -5,4 = 20,95(2)
Từ (1)(2) suy ra a = 0,25 ; b = 0,1
%m O2 = 0,1.32/(0,25.71 + 0,1.32) .100% = 15,27%

đặt số mol Cl2 là x và số mol O2 là y
Dùng định luật bảo toàn e
Mg - 2e ---> Mg2+
0,2 2.0,2
Al - 3e ---> Al3+
0,3 3.0,3
Cl2 + 2e ---> 2Cl-
x 2.x
O2 + 4e ---> 2O2-
y 4.y
ta có phương trình : 2x + 4y = 0,4 + 0,9
Áp dụng định luật BTKL: 4,8 + 8,1 + 71.x + 32.y = 37,05
giải hệ ta được x = 0,25 mol, y = 0,2 mol --> thể tích của A là (0,25 + 0,2).22,4 =10,08 lít
a)VCl2= 0,25*22,4=5,6=> %VCl2=5,6/10,08*100%=55,5%
VO2= 44,5%
b)
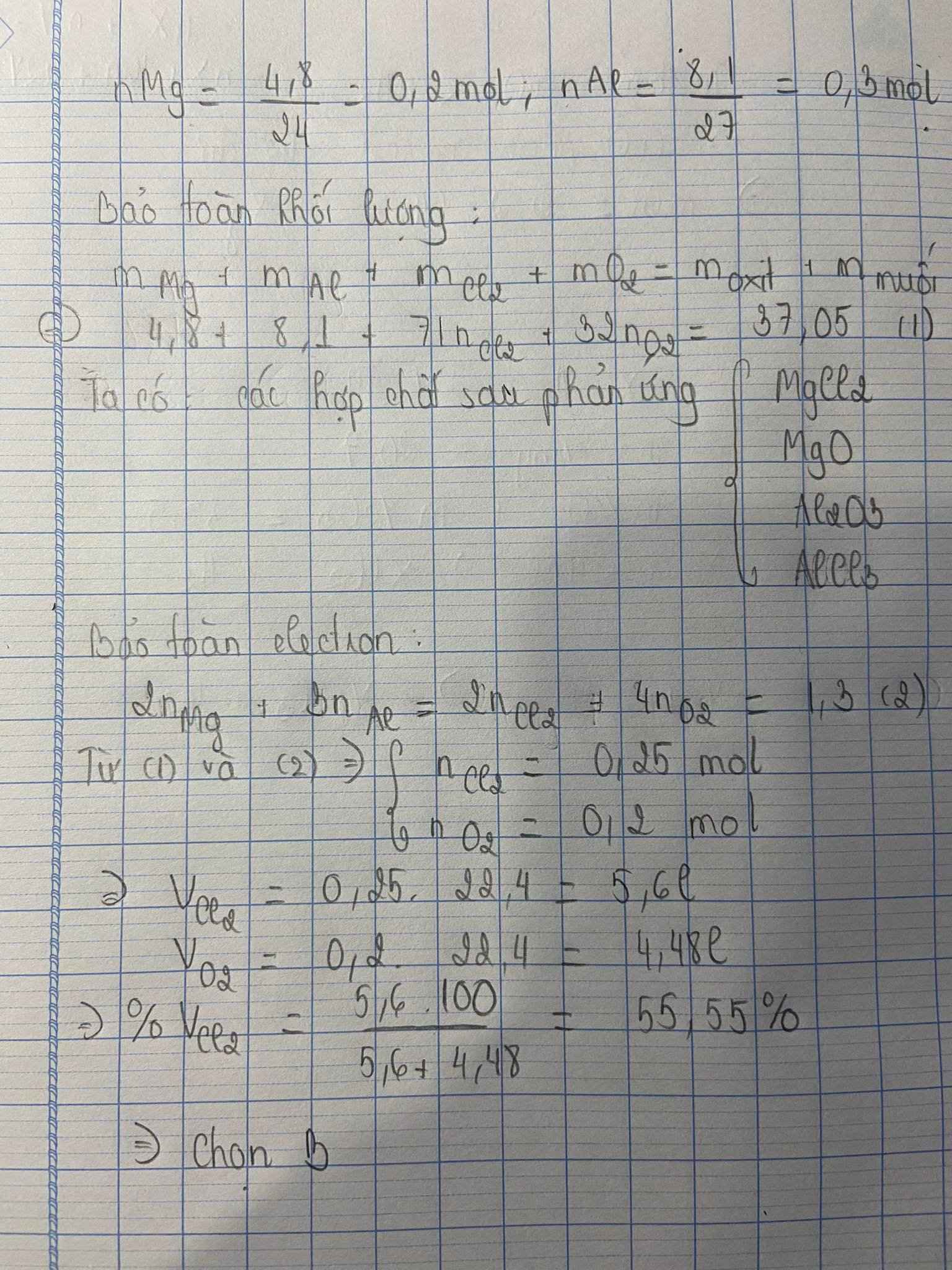
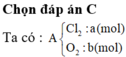
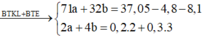
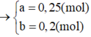
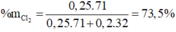

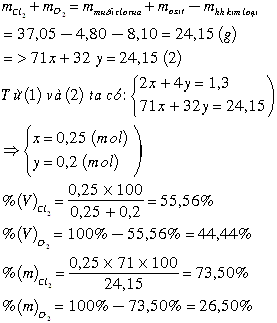
Gọi số mol Cl 2 và O 2 lần lượt là x và y, ta có hệ phương trình:
2x+4y = 0,4+0,9 ( ĐL bảo toàn e) x=0,25
71x+32y = 24,5 ( ĐL bảo toàn khối lượng) y=0,2