Ngâm đinh sắt sạch trong 200 ml dd CuSO4. Sau phản ứng kết thúc lấy đinh sắt ra rửa nhẹ và làm khô thấy khối lượng đinh sắt tăng 8 gam. Nồng độ CuSO4 ban đầu là:
A. 0,52 M
B. 0,5 M
C. 5 M
D. 0,25 M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n C U S O 4 = x.0,2 mol
F e + C u S O 4 → F e S O 4 + C u
x.0,2 x.0,2 x.0,2 (mol)
Khi nhúng thanh Fe vào dung dịch C u S O 4 , thanh Fe lúc sau có khối lượng tăng lên 1,6 gam là:
m C u b a m v a o - m F e tan = 1,6 g
⇔ 0,2x.64 - 0,2x.56 = 1,6
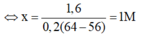
⇒ Chọn C.

Gọi a là số mol C u S O 4 tham gia phản ứng
Phương trình hóa học:
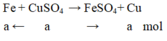
Theo đề bài ta có: m C u b á m v à o – m F e tan r a = m K L t ă n g
64a – 56a = 0,8 ⇒ a = 0,01 mol
Nồng độ dung dịch C u S O 4 là: C M = n V = 0,01 0,2 = 0,5 M
⇒ Chọn C.

Fe + CuSO4 → FeSO4 + Cu
1mol 1 mol => tăng 8 gam
x mol x mol tăng 0,8gam
=> x= 0,8:8= 0,1 mol
=> CM ( dung dịch CuSO4) = 0,1:0,2= 0,5 M
Bài 3 :
Pt : \(Fe+CuSO_4\rightarrow FeSO_4+Cu|\)
1 1 1 1
x 0,1 x
Gọi x là số mol của Fe
Vì khối lượng của sắt tăng so với ban đầu nên ta có phương trình :
\(m_{Cu}-m_{Fe}=0,8\left(g\right)\)
64x - 56x = 0,8
8x = 0,8
⇒x = \(\dfrac{0,8}{8}=0,1\)
\(n_{CuSO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddCuSO4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Chúc bạn học tốt

Đáp án B
Fe + Cu2+ → Fe2+ + Cu
Mol x → x
=> DmThanh KL(tăng) = mCu – mFe pứ = 64x – 56x = 1,6
=> x = 0,2 mol => nCuSO4 = nCu = 0,2 mol
=> CM(CuSO4) = 0,2 : 0,1 = 2M

Đáp án C
Phản ứng: Fe + CuSO4 → FeSO4 + Cu.
Nhận xét: cứ 1 mol CuSO4 phản ứng thì làm mất 1 mol Fe và tạo thêm 1 mol Cu
→ Khối lượng thanh sắt tăng thêm tương ứng 64 – 56 = 8 gam.
Theo đó, để thanh sắt tăng thêm 3,2 gam thì tương ứng số mol CuSO4 phản ứng là 3,2 : 8 = 0,4 mol.
Vậy, giá trị của x = 0,4 ; 0,2 = 2,0
Đáp án C.