Bài 2: Lập công thức hóa học của các chất sau và tính phân tử khối.
Chất Công thức hóa học Phân tử khối
1. Clo ( 2Cl)
2. Magie hidroxit ( 1Mg,
2O, 2H)
3. Kẽm clorua ( 1Zn,
1Cl)
4. Đồng (1Cu)
5. Nhôm oxit ( 2Al, 3O)
6. Amoniac ( 1N, 3H)
7. Bạc (1Ag)
8. Axitsunfnfuric (2H,
1S, 4O)

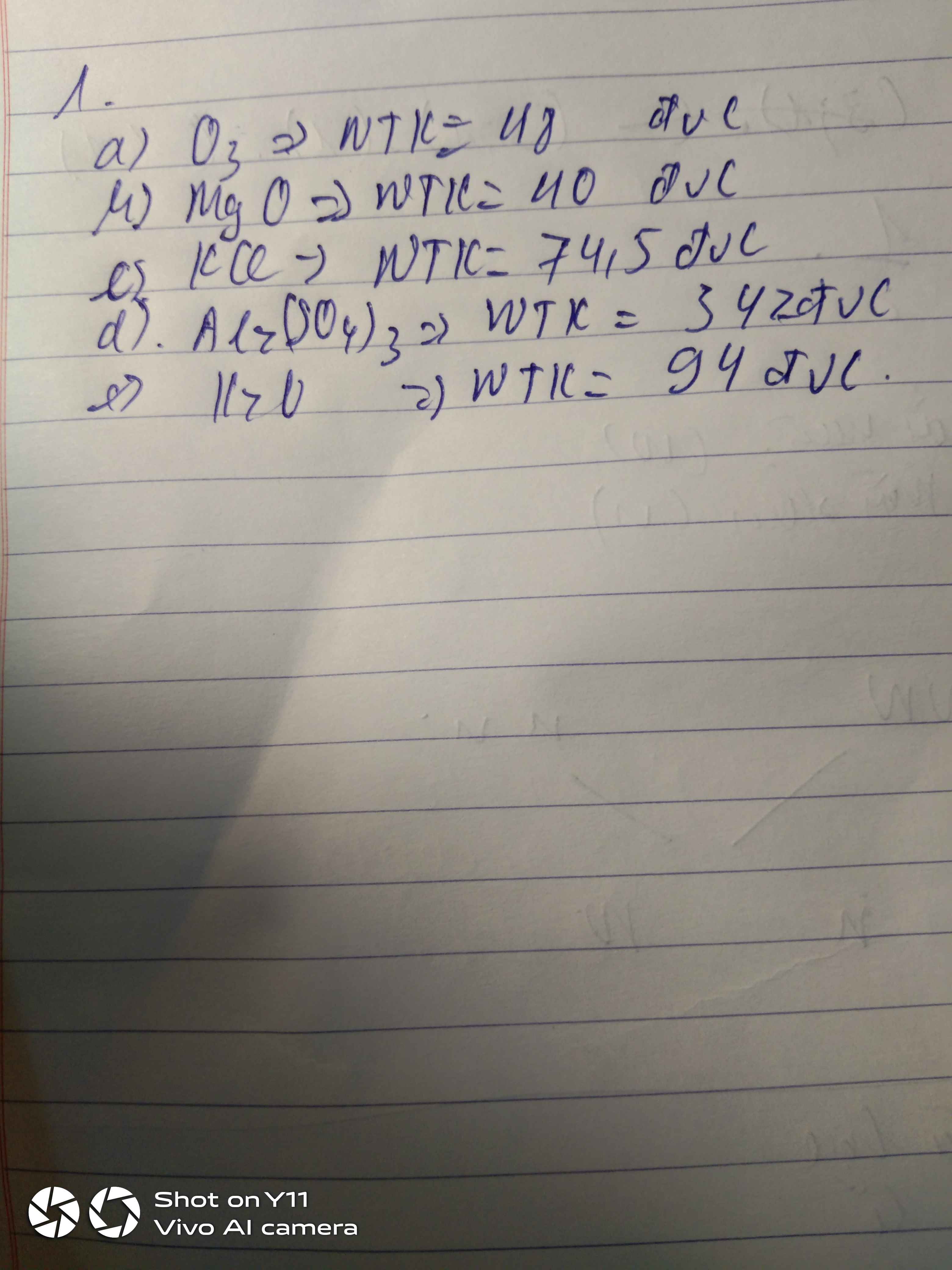

Bài 2:
1. Cl2
\(PTK_{Cl_2}=2.NTK_{Cl}=2.35,5=71\left(đ.v.C\right)\)
2. Mg(OH)2
\(PTK_{Mg\left(OH\right)_2}=NTK_{Mg}+2.\left(NTK_O+NTK_H\right)\\ =24+2.\left(16+1\right)=58\left(đ.v.C\right)\)
3. ZnCl2 (2Cl mới đúng)
\(PTK_{ZnCl_2}=NTK_{Zn}+2.NTK_{Cl}=65+2.35,5=136\left(đ.v.C\right)\)
4. Cu
NTKCu= 64(đ.v.C)
5. Al2O3
\(PTK_{Al_2O_3}=2.NTK_{Al}+3.NTK_O=2.27+3.16=102\left(đ.v.C\right)\)
6. NH3
\(PTK_{NH_3}=NTK_N+3.NTK_H=14+3.1=17\left(đ.v.C\right)\)
7. Ag
NTKAg=108(đ.v.C)
8. H2SO4
\(PTK_{H_2SO_4}=2.NTK_H+NTK_S+4.NTK_O\\ =2.1+32+4.16=98\left(đ.v.C\right)\)
1.Cl2 (71)
2. Mg(OH)2 (58)
3. ZnCl2 (136)
4. Cu (64)
5. Al2O3 (102)
6. NH3 (17)
7. Ag (108)
8. H2SO4 (98)