Để sản xuất 100,0 kg loại thủy tinh có công thức N a 2 O .CaO.6 S i O 2 cần phải dùng x kg natri cacbonat, với hiệu suất của quá trình sản xuất là 100%. Giá trị của x là
A. 22,17 B. 27,12
C. 25,15 D. 20,92
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

6 S i O 2 + C a C O 3 + N a 2 C O 3 → N a 2 O . C a O .6 S i O 2 + 2 C O 2 106 g → 478 g x → 100 k g
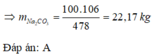

\(n_{thủy-tinh}=\dfrac{6,77.1000}{677}=10\left(kmol\right)\\ n_{K_2CO_3}=n_{PbCO_3}=n_{ttinh}=10\left(kmol\right)\\ n_{SiO_2}=6n_{ttinh}=60\left(kmol\right)\)
Suy ra:
\(m_{K_2CO_3}=10.138=1380\left(kg\right)\\ m_{PbCO_3}=10.267=2670\left(kg\right)\\ m_{SiO_2}=60.60=3600\left(kg\right)\)

ĐÁP ÁN C
VC2H5OH = 10.46/100 = 4,6 lit => mC2H5OH = 3680g = 3,68 kg
(C6H10O5)n -> 2nC2H5OH
162n 2n.46 (g)
6,48 <- 3,68 (kg)
Thực tế cần dùng : m = 6,48.100/80 = 8,1 kg

Khối lượng 1 mol phân tử thủy tinh K2O.PbO.6SiO2 là 677g
=
x 138 = 1,38 (tấn)
=
x 267 = 2,67 (tấn)
=
x 6 x 60,0 = 3,6 (tấn)
Để nấu được 6,77 tấn thủy tinh trên cần dùng 13,8 tấn K2CO3, 2,67 tấn PbCO3 và 3,6 tấn SiO2.

Khối lượng 1 mol phân tử thủy tinh K2O.PbO.6SiO2 là 677g
=
x 138 = 1,38 (tấn)
=
x 267 = 2,67 (tấn)
=
x 6 x 60,0 = 3,6 (tấn)
Đáp án: A.
Ta có sơ đồ: