Ngâm một thanh Kẽm trong 100 ml dung dịch F e N O 3 2 xM. Sau khi phản ứng kết thúc lấy thanh kẽm ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng thanh kẽm giảm 1,35 gam. Giá trị của x là
A. 1
B. 1,5
C. 0,15
D. 0,2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

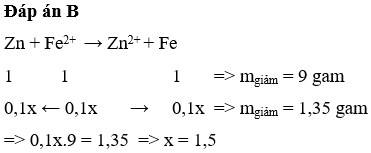

\(Fe+Cu\left(NO_3\right)_2->Fe\left(NO_3\right)_2+Cu\\ \Delta m=0,1x\left(64-56\right)=0,8\\ x=1\left(M\right)\)
Gọi a là số mol Cu(NO3)2 tham gia phản ứng
Phương trình hóa học:
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
a ← a → a a mol
Theo đề bài ta có: mCu bám vào – mFe tan ra = mKL tăng
64a – 56a = 0,8 a = 0,1
Nồng độ dung dịch Cu(NO3)2 là:
x = 0,1/0,1 = 1M.

n C U S O 4 = x.0,2 mol
F e + C u S O 4 → F e S O 4 + C u
x.0,2 x.0,2 x.0,2 (mol)
Khi nhúng thanh Fe vào dung dịch C u S O 4 , thanh Fe lúc sau có khối lượng tăng lên 1,6 gam là:
m C u b a m v a o - m F e tan = 1,6 g
⇔ 0,2x.64 - 0,2x.56 = 1,6
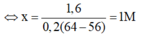
⇒ Chọn C.