Tổng số hạt cơ bản (proton, nơtron, electron) trong ion M + là 57. Trong bảng tuần hoàn M nằm ở
A. chu kì 4, nhóm IA. B. chu kì 3, nhóm IA.
C. chu kì 4, nhóm IIA. D. chu kì 3, nhóm IIA
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo đề bài ta có : 2Z + N = 40
N ≥ Z . Vì vậy ta có : 3Z ≥ 40, do đó Z ≤ 40/3 = 13,3 (1)
Măt khác : N/Z ≤ 1,5 → N ≤ 1,5Z
Từ đó ta có : 2Z + N ≤ 2Z + 1,5Z; 40 ≤ 3,5Z
→ Z ≥ 40/3,5 = 11,4 (2)
Tổ hợp (1) và (2) ta có : 11,4 ≤ Z ≤ 13,3 mà z nguyên. Vậy Z= 12 và Z = 13.
Nếu Z = 12 thì N = 16 và A = 28 (trái với đề bài A < 28)
Vậy Z = 13. Đó là nguyên tố nhôm (Al).
Vị trí của nhôm trong bảng tuần hoàn :
+ Ô số 13 ;
+ Chu kì 3 ;
+ Nhóm IIIA.

Cái này chắc hóa 7 không vậy fen=))
C16:
\(2p+12=24\Rightarrow p=6:Cacbon:1s^22s^22p^2\)
Chu kì 2, nhóm IVA, là phi kim (có 4 e hóa trị lớp ngoài cùng)
Đề cho đáp án sai, sure=0
C17: B
C18: \(\%K=\dfrac{39.100}{39+14+16.3}=38,61\%\)
Chọn A
C19: \(p+12=24\Rightarrow p=12\) => ô 12
Chọn A
C20: liên kết ion
Liên kết ion của 2 nguyên tử trong 1 phân tử là lấy giá trị tuyệt đối của hiệu độ âm điện của 2 nguyên tử tính ra lớn hoặc bằng 1,7.

B
X và Y là hai kim loại cùng nhóm A.
=> Y có nhiều hơn X là 8 hoặc 18 hoặc 32 electron.
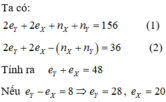
(không thuộc 2 chu kì)(loại).
![]()
Vậy 2 nguyên tố này là As và P, cùng thuộc nhóm VA và thuộc 2 chu kì (nhận).
![]()
(không thuộc 2 chu kì liên tiếp) (loại).
Vậy X là photpho (P).

Cấu hình của A: 1s22s22p5
Có 7e lớp ngoài cùng => A thuộc nhóm VIIA
Có 2 lớp e => A thuộc chu kì 2
=> B
Ta có: P + E + N -1 = 57 ↔ 2P + N = 58 ↔ N = 58 - 2P (1)
Mặt khác ta có công thức : 1 ≤ N/P ≤ 1,5(2)
Thay (1) vào (2) ta có : P ≤ 58 - 2P ≤ 1,5P ↔ 16,57 ≤ P ≤ 19,33
P có 3 giá trị 17, 18, 19
P = 17 : cấu hình e thu gọn 2/8/7 → loại
P = 18 : cấu hình e thu gọn 2/8/8 → loại
P = 19 : cấu hình e thu gọn 2/8/8/1 → chu kì 4 nhóm IA → chọn Đáp án A.