2. Để đốt cháy hết 13,2 gam hỗn hợp gồm bột Fe và Mg cần dùng hết 4,48 lít khí
O2 (đktc) tạo ra sản phẩm là Fe3O4 và MgO theo phản ứng:
Fe + O2 ⎯⎯to→ Fe3O4; Mg + O2 ⎯⎯to→ MgO Tính khối lượng mỗi chất có
trong hỗn hợp ban đầu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Theo ĐLBTKL: \(m_{Fe\left(bđ\right)}+m_{O_2}=m_X\)
=> \(m_{O_2}=26,4-20=6,4\left(g\right)\)
=> \(n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\Rightarrow V=0,2.22,4=4,48\left(l\right)\)
b)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,2------->0,1
=> \(\%m_{Fe_3O_4}=\dfrac{0,1.232}{26,4}.100\%=87,88\%\)
c)
- Nếu dùng KClO3
PTHH: 2KClO3 --to--> 2KCl + 3O2
\(\dfrac{0,4}{3}\)<-----------------0,2
=> \(m_{KClO_3}=\dfrac{0,4}{3}.122,5=\dfrac{49}{3}\left(g\right)\)
- Nếu dùng KMnO4:
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,4<--------------------------------0,2
=> \(m_{KMnO_4}=0,4.158=63,2\left(g\right)\)

Đáp án B
Quy đổi hỗn hợp về Fe và O. Đặt nFe = a và nO = b
+ Vì HNO3 dư và nFe(NO3)3 = 0,4 mol ⇒ nFe = a = 0,4 mol
+ Áp dụng bảo toàn e ta có: 3nFe = 2nO + 3nNO
⇒ nO = 0,3 mol ⇒ m = 0,4×56 + 0,3×16 = 27,2 gam

Gọi \(n_{Fe\left(X\right)}=a\left(mol\right)\)
Ta có sơ đồ phản ứng:
\(Fe+O_2\xrightarrow[]{t^o}X\left\{{}\begin{matrix}Fe\\FeO\\Fe_3O_4\\Fe_2O_3\end{matrix}\right.\xrightarrow[]{+HNO_{3\left(lo\text{ãng},d\text{ư}\right)}}Fe\left(NO_3\right)_3+NO+H_2O\)
Đặt \(n_{Fe}=a\left(mol\right)\)
BTNT Fe: \(n_{Fe\left(NO_3\right)_3}=n_{Fe}=a\left(mol\right)\)
BTNT N: \(n_{HNO_3}=3n_{Fe\left(NO_3\right)_3}+n_{NO}=3a+0,06\left(mol\right)\)
BTNT H: \(n_{H_2O}=\dfrac{1}{2}n_{HNO_3}=1,5a+0,03\left(mol\right)\)
Áp dụng ĐLBTKL:
\(m_X+m_{HNO_3}=m_{Fe\left(NO_3\right)_3}+m_{NO}+m_{H_2O}\)
\(\Rightarrow11,36+63.\left(3a+0,06\right)=242a+0,06.30+18.\left(1,5a+0,03\right)\)
\(\Leftrightarrow a=0,16\left(mol\right)\)
\(\Rightarrow m=m_{Fe}=0,16.56=8,96\left(g\right)\)

- Từ quá trình phản ứng ta thấy số oxi hoá của các chất phản ứng ở trạng thái đầu là
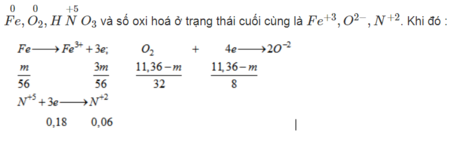
Áp dụng ĐLBT electron ta có:
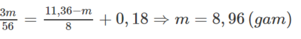

Đáp án D
X gồm NO (x mol) và H2 (y mol)
x+y=0,25
20x+2y=0,25.3,8.2
=>x=0,05; y=0,2
BTKL: mR+mH2SO4=m muối+mNO+mH2+mH2O
=>mH2O=38,36+0,87.98-111,46-0,05.30-0,2.2=10,26 gam=>nH2O=0,57 mol
BTNT H: 2nH2SO4=4nNH4++2nH2+2nH2O=>nNH4+=(0,87.2-0,57.2-0,2.2)/4=0,05 mol
BTNT N: nNO3-=nNH4++nNO=0,05+0,05=0,1 mol=>nFe(NO3)2=0,05 mol
Giả sử Mg (a mol), Fe3O4 (b mol)
Dung dịch muối gồm: ion KL, 0,05 mol NH4+, 0,87 mol SO4 2-
24a+232b+0,05.180=38,36
24a+56(3b+0,05)=111,46-0,05.18-0,87.96 (KL ion KL)
=>a=0,45;b=0,08
%mFe3O4=232.0,08/38,36=48,38%

Đáp án A
,nO2 = 0,1875 mol
Bảo toàn khối lượng : mA + mO2 = mCO2 + mN2 + mH2O
=> mCO2 + mN2 = 7,3g
Mặt khác : nCO2 + nN2 = 0,175 mol
=> nCO2 = 0,15 ; nN2 = 0,025 mol
Bảo toàn O : nO(A) = 2nCO2 + nH2O – 2nO2 = 0,1 mol
=> nC : nH : nO : nN = 0,15 : 0,0,35 : 0,1 : 0,05 = 3 : 7 : 2 : 1
Vì A chỉ có 1 nguyên tử N nên A có CTPT là : C3H7O2N
Gọi x, y lần lượt là số mol của Fe và Mg.
Theo đề, ta có: \(56x+24y=13,2\) (*)
Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\left(1\right)\)
\(2Mg+O_2\overset{t^o}{--->}2MgO\left(2\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{2}{3}.n_{Fe}=\dfrac{2}{3}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{1}{2}.n_{Mg}=\dfrac{1}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{2}{3}x+\dfrac{1}{2}y=0,2\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}56x+24y=13,2\\\dfrac{2}{3}x+\dfrac{1}{2}y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)
đktc là gì ạ