Người ta dùng khí cacbon oxit để khử đồng (II) oxit. Nếu khử a gam đồng (II) oxit thì thu được bao nhiêu gam đồng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

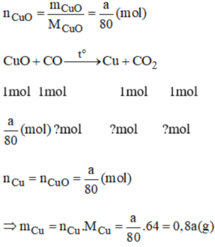

\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{H_2}=n_{Mg}=0,2\left(mol\right)\\ n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\\ CuO+H_2\underrightarrow{^{to}}Cu+H_2O\\ Vì:\dfrac{0,25}{1}>\dfrac{0,2}{1}\\ \Rightarrow CuOdư\\ \Rightarrow n_{Cu}=n_{H_2}=0,2\left(mol\right)\\ m_{Cu}=0,2.64=12,8\left(g\right)\)
\(n_{Mg}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,2 0,2
\(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\)
Pt : \(H_2+CuO\rightarrow\left(t_o\right)Cu+H_2O|\)
1 1 1 1
0,2 0,25 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\)
⇒ H2 phản ứng hết , CuO dư
⇒ Tính toán dựa vào số mol của H2
\(n_{Cu}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{Cu}=0,2.64=12,8\left(g\right)\)
Chúc bạn học tốt

\(Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ \text{Theo PTHH : } n_{H_2} = n_{H_2O} = \dfrac{9}{18} = 0,5(mol)\\ \text{Bảo toàn khối lượng : } m_{Oxit} + m_{H_2} = m_{kim\ loại} + m_{H_2O}\\ \Rightarrow m_{kim\ loại} = 32 + 0,5.2 - 9 = 24(gam)\)

a) Phương trình hóa học của các phản ứng:
H2 + CuO → Cu + H2O (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b) Trong phản ứng (1), (2) chất khử H2 vì chiếm oxi của chất khác, chất oxi hóa là CuO và Fe2O3 vì nhường oxi cho chất khác.
c) Khối lượng đồng thu được từ 6g hỗn hợp 2 kim loại thu được:
mCu = 6g - 2,8g = 3,2g, nCu = 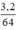 = 0,05 mol
= 0,05 mol
nFe = 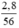 = 0,05 (mol)
= 0,05 (mol)
nH2 (1) = nCu = 0,05 mol ⇒ VH2(1) = 22,4 . 0,05 = 1,12 lít
nH2 (2) = 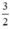 . nFe =
. nFe = 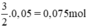 ⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
VH2 = VH2(1) + VH2(2) = 1,12 + 1,68 = 2,8(l)

a) PTHH:
CuO + H2 =(nhiệt)=> Cu + H2O (1)
Fe2O3 + 3H2 =(nhiệt)=> 2Fe + 3H2O (2)
b) - Dựa vào định nghĩa chất khử và chất oxi hóa
=> Chất khử: H2
Chất Oxi hóa: CuO và Fe2O3
c) Lượng đồng có trong 6g hỗn hợp 2 kim loại thu được:mCu = 6g - 2,8g = 3,2g.
VH2 cần dùng theo phương trình phản ứng(1) = \(\dfrac{3,2}{64}\cdot64=1,12\left(l\right)\) =
VH2 cần dùng theo phương trình phản ứng(2) = \(\dfrac{2,8}{56}\cdot\dfrac{3}{2}\cdot22,4=1,68\left(l\right)\)
a.Phương trình phản ứng:
CuO + H2 Cu + H2O (1)
1mol 1mol 1mol 1mol
Fe2O3 + 3H2 3H2O + 2Fe (2)
1mol 3mol 3mol 2mol
b. + Chất khử là H2 vì chiếm oxi của chất khác;
+ Chất oxi hóa: CuO, Fe2O3 vì nhường oxi cho chất khác.
c. Số mol đồng thu được là: nCu = = 0,5 (mol)
Số mol sắt là: nFe = = 0,05 (mol)
Thể tích khí H2 cần dùng để khử CuO theo phương trình phản ứng (1) là: nH2 = nCu = 0,05 mol => VH2 = 22,4.0,05 = 1,12 (lít)
Khí H2 cần dùng để khử Fe2O3 theo phương trình phản ứng (2) là:
nH2 = nFe =
.0,05 = 0,075 mol
=>VH2(đktc) = 22,4.0,075 = 1,68 (lít)

nCuO = 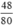 = 0,6 mol.
= 0,6 mol.
Phương trình hóa học của phản ứng khử CuO:
CuO + H2 → Cu + H2O.
nCu = 0,6mol.
mCu = 0,6 .64 = 38,4g.
Theo phương trình phản ứng trên:
nH2 = 0,6 mol
VH2 = 0,6 .22,4 = 13,44 lít.

a) \(2CuO+C-^{t^o}\rightarrow2Cu+CO_2\)
\(2PbO+C-^{t^o}\rightarrow2Pb+CO_2\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
b) \(n_C=0,075\left(mol\right);n_{CO_2}=0,06\left(mol\right)\)
Vì nCO2 < nC => Sau phản ứng C dư
Gọi x,y là số mol của CuO, PbO
Ta có : \(\left\{{}\begin{matrix}\dfrac{1}{2}x+\dfrac{1}{2}y=0,06\\80x+223y=12,46\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,1\\y=0,02\end{matrix}\right.\)
=> \(\%m_{CuO}=\dfrac{0,1.8}{12,46}.100=64,21\%\)
%m PbO =35,79%
