Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch hỗn hợp gồm x mol Al2(SO4)3 và y mol H2SO4, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Giá trị của x + y là?

A. 0,30.
B. 0,20.
C. 0,40.
D. 0,35.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Định hướng tư duy giải
Từ đồ thị thấy ngay: 2y = 0,4 → y = 0,2
Tại vị trí 1,1 ta có
![]()

Đáp án A
Từ đồ thị thấy ngay 2y = 0,4 → y = 0,2
Tại vị trí 1,1 ta có: 1,1= 0,4+2x.3+(2x-0,1)=> x= 0,1

Đáp án : B
+) Tại nNaOH = 0,4 mol thì trung hòa vừa hết axit
=> x = 0,2 mol
Tại nNaOH = 1 mol => Al3+ dư
Tại nNaOH = 1,4 mol thì kết tủa tan 1 phần
n A l ( O H ) 3 = 4 n A l 3 + - n N a O H - n H C l
⇒ n A l 3 + = 0 , 3 m o l
=> y = 0,15 mol
Nếu thêm n B a O H 2 = 0 , 05 m o l vào X :
=> Kết tủa : 0,2 mol Al(OH)3 và 0,5 mol BaSO4
=> m = 132,1g

Đáp án C
Đồ thị trải qua các giai đoạn:
+Giai đoạn chưa xuất hiện kết tủa do NaOH tác dụng với H2SO4.
+Kết tủa tăng dần đến cực đại do NaOH tác dụng với Al2(SO4)3tạo kết tủa Al(OH)3.
+Kết tủa giảm dần do NaOH hòa tan Al(OH)3.
![]()
Nhận thấy lúc 1 mol NaOH phản ứng và 1,4 mol NaOH phản ứng đều thu được cùng một lượng kết tủa, chứng tỏ 0,4 mol NaOH chênh lệch đã tạo 1 lượng kết tủa và hòa tan lượng kết tủa đó.
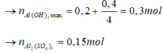
Cho 0,7 mol Ba(OH)2 vào X thì kết tủa thu được gồm BaSO40,65 mol và Al(OH)3.
![]()
Vậy m=167,05 gam

Đồ thị trải qua các giai đoạn:
+Giai đoạn chưa xuất hiện kết tủa do NaOH tác dụng với H2SO4.
+Kết tủa tăng dần đến cực đại do NaOH tác dụng với Al2(SO4)3tạo kết tủa Al(OH)3.
+Kết tủa giảm dần do NaOH hòa tan Al(OH)3.
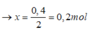
Nhận thấy lúc 1 mol NaOH phản ứng và 1,4 mol NaOH phản ứng đều thu được cùng một lượng kết tủa, chứng tỏ 0,4 mol NaOH chênh lệch đã tạo 1 lượng kết tủa và hòa tan lượng kết tủa đó.
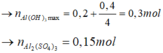
Cho 0,7 mol Ba(OH)2 vào X thì kết tủa thu được gồm BaSO40,65 mol và Al(OH)3.
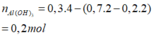
Vậy m=167,05 gam

Đáp án : C
nNaOH pứ muối = nNaOH – 2a (mol)
Khi số mol NaOH = 0,1 sẽ cùng tạo ra kết tủa với 2 trường hợp :
+) Al3+ dư => n↓ = 1/3 nNaOH = 1 3 (0,5 – 2a) = 0,1 => a = 0,1
+) Kết tủa tan=> n↓ = 4nAl3+ - nOH- = 4.2b – (0,9 – 2a) = 8b + 2a – 0,9 = 0,1
=> b = 0,1
=> a : b = 1 : 1

Đáp án C
Từ đồ thị dễ dàng thấy được nNaOH = x = 0,6 mol.
Tại thời điểm nHCl = 0,8 mol ta thấy nAl(OH)3 = 0,2 mol.
Ta có nAlO2– chưa tạo kết tủa = 1 , 6 - 0 , 8 4 = 0 , 2
⇒ ∑nAlO2– = 0,2 + 0,2 = y = 0,4 mol.
⇒ nNaAlO2 = 0,4 mol ⇒ x + y = 1 mol
CHÚ Ý
+ Với các loại bài toán về đồ thị để giải nhanh và chính xác được các bạn nên tư duy theo hướng phân chia nhiệm vụ của yếu tố thuộc trục hoành.
+ Với bài toán này ở mỗi giai đoạn Ba(OH2) làm những nhiệm vụ sau:
Giai đoạn 1: Trung hòa H+
Giai đoạn 2: Đưa kết tủa lên cực đại.
Giai đoạn 3: Hòa tan kết tủa Al(OH)3