Hỗn hợp X chứa etylamin và trimetylamin. Hỗn hợp Y chứa 2 hiđrocacbon mạch hở có số liên kết (∏) nhỏ hơn 3. Trộn X và Y theo tỉ lệ mol nX : nY = 1: 5 thu được hỗn hợp Z. Đốt cháy hoàn toàn 3,17 gam hỗn hợp Z cần dùng vừa đủ 7,0 lít khí oxi (đktc), sản phẩm cháy gồm CO2, H2O và N2 được dẫn qua dung dịch NaOH đặc, dư thấy khối lượng dung dịch tăng 12,89 gam. Phần trăm khối lượng của etylamin trong X gần nhất với giá trị nào sau đây?
A. 71%.
B. 70%.
C. 29%.
D. 30%

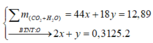
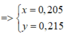
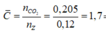
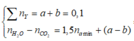
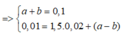
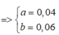
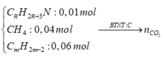
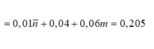
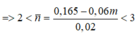
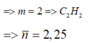
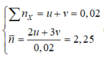
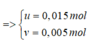
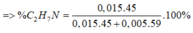

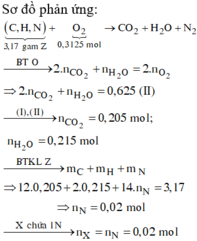
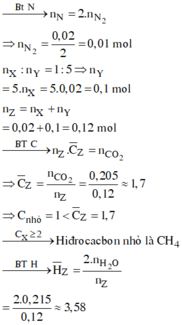

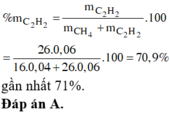

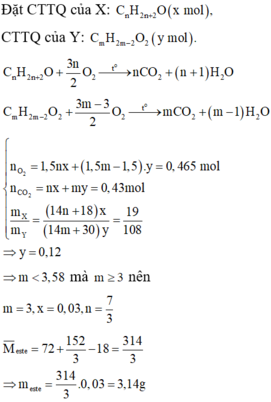
Đáp án B
nO2 = 7/22,4 = 0,3125 (mol)
Gọi số mol của X và Y lần lượt là a và 5a (mol)
BTKL: mZ + mO2 = mCO2 + mH2O + mN2
=> mCO2 + mH2O + mN2 = 3,17 + 0,3125.32 =13,17(g) (1)
Khối lượng dung dịch NaOH đặc tăng chính là khối lượng của CO2 và H2O
=> mCO2 + mH2O = 12,89 (g) (2)
Từ (1) và (2) => mN2 = 0,28 (g) => nN2 = 0,01 (mol)
BTNT N => nX = 2nN2 = 0,02 (mol)
=> nZ = 6nX = 0,12 (mol)
Gọi x và y lần lượt là số mol của CO2 và H2O
=> Y phải có CH4
TH1: Hidrocacbon còn lại trong Y không có liên kết pi
=> nH2O – nCO2 = 1,5namin + nY => ta thấy không thỏa mãn vì: 0,01 #0,08 => loại
TH2: Hidrocacbon còn lại trong Y không có 1 liên kết pi
=> nH2O – nCO2 = 1,5namin + nCH4 ( Vì đốt HC có 1 liên kết pi cho mol CO2 = H2O )
=> nCH4 = ( 0,215 – 0,205) – 1,5.0,02 = - 0,02 (mol) < 0 => loại
TH3: Hidrocacbon còn lại trong Y không có 2 liên kết pi
Gọi a và b lần lượt là số mol của CH4 và CmH2m-2 trong Y