Cho m gam K vào 500 ml dung dịch H N O 3 thu được dung dịch X và 0,015 mol hỗn hợp 2 khí. Thêm KOH dư vào dung dịch X thu được 0,01 mol khí Y. Tính m (biết H N O 3 chỉ tạo ra một sản phẩm khử duy nhất)
![]()
![]()
![]()
![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

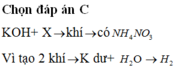
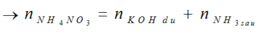
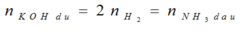
![]()
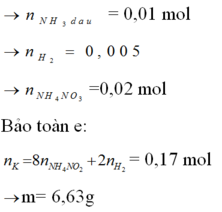

KOH + X → khí → có NH4NO3.
Vì tạo 2 khí → K dư + H2O → H2.
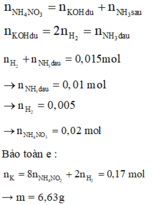
Đáp án A

BTKL có: nO trong Y = (3,24 - 0,04.56 - 0,015.64)/16 = 0.0025 mol
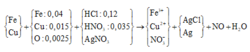


Đáp án B

Đáp án C
Xử lí dự kiện Y:
+ Xét phần 1: đặt n C O 3 2 - p u = x ; n H C O 3 - = y
![]()
![]()
trong Y: n C O 3 2 - : n H C O 3 - = 3 : 2
+ Xét phần 2:
n C O 3 2 - = n H + - n C O 2 = 0 , 06 m o l
⇒ n H C O 3 - = 0 , 04 m o l
⇒ trong Y ban đầu chứa 0,12 mol C O 3 2 - và 0,08 mol H C O 3 -
⇒ Quy hỗn hợp về Na, Ba, O
Bảo toàn nguyên tố Ba và Cacbon:
n B a = n B a C O 3 = 0 , 32 - 0 , 12 - 0 , 08 = 0 , 12
Bảo toàn điện tích:
n N a = n N a + = 0 , 32 m o l
Bảo toàn e: n N a + 2 n B a = 2 n O + 2 n H 2
![]()

Đáp án D
Đặt nKCl = a và nKClO3 = b.
⇒ 74,5a + 122,5b = 39,4 (1).
+ Ta có 6,74 gam chất rắn gồm MnO2 và AgCl [Trong đó mMnO2 = 10 gam].
⇒ ∑nAgCl = ∑nCl = 67 , 4 - 10 143 , 5 = 0,4 mol.
⇒ PT bảo toàn Clo là: a + b = 0,4 (2).
+ Giải hệ (1) và (2) ta có: nKCl = nKClO3 = 0,2 mol.
⇒ nKhí P = nO2 = 1,5×0,2 = 0,3 mol ⇒ 1 3 P chính là 0,1 mol O2.
+ 0,1 mol O2 sẽ oxi hóa Fe2+ → Fe3+ ||⇒ nFe3+ = 0 , 1 × 4 1 = 0,4 mol.
⇒ PHản ứng với Ba(OH)2 thì kết tủa bao gồm:
nFe(OH)2 = 0,1, nFe(OH)3 = 0,4 và nBaSO4 = 0,8 mol.
⇒ mKết tủa = 0,1×90 + 0,4×107 + 0,8×233 = 238,2 gam