Hòa tan hoàn toàn 35,1 gam kim loại M hóa trị II trong dung dịch H2SO4 loãng dư, thu được 1,08 gam khí H2. Kim loại M là:
A. Be.
B. Mg.
C. Zn.
D. Ca.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D.
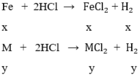
gọi x, y lần lượt là số mol của Fe và M trong hỗn hợp
số mol H2 là 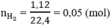
theo bài ra ta có hệ phương trình
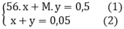
từ (2) → x= 0,05 – y
thay vào (1) ta được 56(0,05 – y) + My = 0,5
⇔ 2,8 – 56y + My = 0,5
2,3 = 56y – My
→ y = 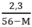
Ta có 0 < y < 0,05
y > 0 ↔ 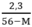 > 0 → 56 – M > 0 ⇒ M < 56
> 0 → 56 – M > 0 ⇒ M < 56
y < 0,05 ↔ 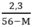 < 0,05 → 2,3 < 0,05(56 – M) → M < 10
< 0,05 → 2,3 < 0,05(56 – M) → M < 10
Trong các kim loại hóa trị II chỉ có Be thỏa mãn do đó M là Be

Chọn B
Kim loại hóa trị II Þ nM = nH2 = 0,6 Þ MM = 14,4/0,6 = 24 (Mg).

\(n_{H_2SO_4}=1\cdot0,2=0,2\left(mol\right)\\ PTHH:MO+H_2SO_4\rightarrow MSO_4+H_2O\\ \Rightarrow n_{MO}=n_{H_2SO_4}=0,2\left(mol\right)\\ \Rightarrow M_{MO}=\dfrac{16}{0,2}=80\left(g/mol\right)\\ \Rightarrow PTK_M=80-16=64\left(đvC\right)\)
Do đó M là Cu
Vậy chọn A

Đáp án C.
Gọi kim loại cần tìm là R. Các PTHH:
R + H2SO4 → RSO4 +H2 (1)
H2SO4 + 2NaOH → Na2SO4 + H2O (2)
Số mol H2SO4 là nH2SO4 = 0,15.0,5 = 0,075 (mol);
Số mol NaOH là nNaOH = 0,03.1 = 0,03 (mol)
Theo pt (2) 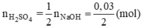
Số mol H2SO4 phản ứng (1) là:
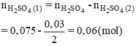
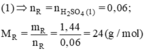
Vậy R là Mg.

PTHH: \(R+H_2SO_4\rightarrow RSO_4+H_2\)
Theo PTHH: \(n_R=n_{H_2}\)
\(\Rightarrow\dfrac{7,2}{R}=\dfrac{6,72}{22,4}\) \(\Rightarrow R=24\)
Vậy kim loại cần tìm là Magie

Gọi hóa trị của M là n.
Ta có: \(n_{H_2}=\dfrac{5,376}{22,4}=0,24\left(mol\right)\)
PT: \(2M+nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nH_2\)
Theo PT: \(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,48}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{15,6}{\dfrac{0,48}{n}}=\dfrac{65}{2}n\left(g/mol\right)\)
Với n = 2 thì MM = 65 (g/mol)
Vậy: M là Zn.
Chọn C.