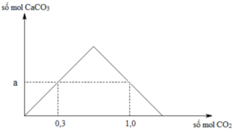
Sục từ từ đến dư CO2 vào một cốc đụng dung dịch Ca(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị. Nếu sục 0,85 mol CO2 vào dung dịch thì lượng kết tủa thu được là
A. 35 gam
B. 40 gam
C. 45 gam
D. 55 gam.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có giá trị a = 0,3 mol.
Tại thời điểm nCO2 = 1 mol trong dung dịch vẫn có nCaCO3 = 0,3 mol.
⇒ Bảo toàn C ⇒ nCa(HCO3)2 = (1 – 0,3) ÷ 2 = 0,35 mol.
⇒ ∑nCa(OH)2 = 0,3 + 0,35 = 0,75 mol.
+ Nếu sục 0,85 mol CO2 vào 0,75 mol Ca(OH)2.
⇒ nCaCO3 = ∑n(OH–) – nCO2 = 0,75 × 2 – 0,85 = 0,45 mol.
⇒ mCaCO3 = 0,45 × 100 = 45 gam
Đáp án C

Ta có giá trị a = 0,3 mol.
Tại thời điểm nCO2 = 1 mol trong dung dịch vẫn có nCaCO3 = 0,3 mol.
⇒ Bảo toàn C ⇒ nCa(HCO3)2 = (1 – 0,3) ÷ 2 = 0,35 mol.
⇒ ∑nCa(OH)2 = 0,3 + 0,35 = 0,75 mol.
+ Nếu sục 0,85 mol CO2 vào 0,75 mol Ca(OH)2.
⇒ nCaCO3 = ∑n(OH–) – nCO2 = 0,75 × 2 – 0,85 = 0,45 mol.
⇒ mCaCO3 = 0,45 × 100 = 45 gam
Đáp án C

Giải thích:
+ Từ đồ thị => a = 0,3 mol.
+ Dễ thấy kết tủa cực đại = 0,3 + (1 – 0,3): 2 = 0,65 mol.
+ Từ kết quả trên ta vẽ lại đồ thị(hình 2): Từ đồ thị này suy ra khi CO2 = 0,85 mol Þ x = 1,3 – 0,85 = 0,45 mol
=> m = 45 gam.
Đáp án C

Đáp án A
nCaCO3 max = nCa(OH)2 = b = 0,5 mol
nCO2 max = nNaHCO3 + 2nCa(HCO3)2
=> nNaHCO3 = nNaOH = a = 0,4 mol
=> a : b = 0,4 : 0,5 = 4 : 5

Đáp án B
Gọi số mol của Ba(OH)2 và NaOH lần lượt là a và b.
Tại thời điểm số mol CO2 là 3,4 mol kết tủa bị hòa tan hết 2a + b = 3,4.
Tại thời điểm số mol CO2 là a mol thu được kết ủa cực đại là a mol BaCO3.
Tại thời điểm số mol CO2 là (a + 1,6) mol thu được kết tủa cực đại là a mol BaCO3.
→ 2a + b = 2. (a + 0,8)
→ a = 0,9 và b = 1,6 → m = 64(g)

Đáp án B
Gọi số mol của Ba(OH)2 và NaOH lần lượt là a và b.
Tại thời điểm số mol CO2 là 3,4 mol kết tủa bị hòa tan hết 2a + b = 3,4.
Tại thời điểm số mol CO2 là a mol thu được kết ủa cực đại là a mol BaCO3.
Tại thời điểm số mol CO2 là (a + 1,6) mol thu được kết tủa cực đại là a mol BaCO3.
2a + b = 2. (a + 0,8)
a = 0,9 và b = 1,6 m = 64(g)
Đáp án C