Hòa tan hoàn toàn hỗn hợp X gồm Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 20% loãng thu được dung dịch Y. Nồng độ của MgSO4 trong dung dịch Y là 15,22%. Nồng độ % của ZnSO4 trong dung dịch Y là :
A. 10,21%
B. 15,22%
C. 18,21%
D. 15,16%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Chọn số mol Mg trong hỗn hợp ban đầu là 1. Khi đó gọi số mol Zn ban đầu là x.
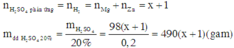
Theo định luật bảo toàn khối lượng ta có:
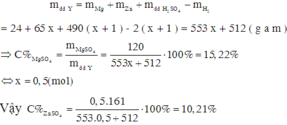

Giả sử số mol H2SO4=1 mol ➞khối lượng dung dịch HCl=98:0,2=490 (g)
X phản ứng vừa đủ với 1 mol H2SO4 sinh ra 1 mol H2
Đặt số mol Zn=x và số mol Mg=y mol ➞\(\Sigma\)khối lượng kim loại=65x+24y
Theo định luật bảo toàn electron➞ 2x+2y=\(2n_{H_2}=2\)
Khối lượng dung dịch sau phản ứng=\(490+65x+24y-1.2=488+65x+24y\)
Nồng độ % MgSO4=\(\frac{y\left(24+96\right)}{488+65x+24y}\)=0,1522%
Giải hệ ta được x=0,333 và y=0,667
➞ Nồng độ % ZnSO4=\(\frac{0,333.\left(65+96\right)}{488+65.0,333+24.0,667}.100\%=10,2\%\)

Chọn đáp án B
L ấ y 1 m o l F e : x m o l M g : x - 1 m o l
F e + 2 H C l → F e C l 2 + H 2 ↑ x 2 x x x
M g + 2 H C l → M g C l 2 + H 2 ↑ 1 - x 2 1 - x 1 - x 1 - x
n H 2 = 1 m o l , n H C l = 2 m o l ⇒ m d d H C l = 2 . 36 , 5 . 100 20 = 365 g m d d Y = 56 x + 24 1 - x + 365 - 1 . 2 = 387 + 32 x
C % F e C l 2 = 127 x 387 + 32 x . 100 % = 15 , 76 % ⇒ x = 0 , 5 m o l ⇒ C % M g C l 2 = 95 . 0 , 5 387 + 32 . 0 , 5 . 100 % = 11 , 79 %

Đáp án B
Fe+2HCl → FeCl2 + H2
a 2a a a
Mg + 2HCl → MgCl2+H2
b 2b b b
mchất rắn X = 56a + 24b ; mddHCl = 36,5/20% .2.(a + b) = 365(a + b)
![]()
⇒ mddsau pư = 56a + 24b + 365(a + b) – 2(a + b) = 419a + 387b
![]() .100 = 15,76
.100 = 15,76
Giải PT ⇒ a = b ⇒ ![]() .100 = 11,79%
.100 = 11,79%