pĐốt cháy hỗn hợp gồm 1,92 gam Mg và 4,48 gam Fe với hỗn hợ khí X gồm clo và oxi, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng vừa đủ 120 ml dung dịch HCl 2M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z, thu được 56,69 gam kết tủa. Phần trăm thể tích của clo trong hỗn hợp X là
A. 51,72%
B. 53,85%
C. 56,36%
D. 76,70%







Đáp án : B
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích :
2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
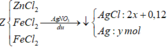
Hòa tan Y bằng HCl : 2Cl thay thế 1 O
=> nO = 1 2 nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
Sau đó phản ứng với AgNO3 tạo :
(2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> % V C l 2 X = 53,85%