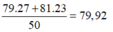Nguyên tử của nguyên tố X có 2 đồng vị A và B. % về số nguyên tử của đồng vị A gấp 1,174 lần % về số nguyên tử của đồng vị B. Đồng vị A có 35 proton và 44 notron. Tổng số khối của hai đồng vị llà160. Xác định nguyên tử khối trung bình của X?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
, AX = 35 + 44 = 79 . Do nY – nX = 2 => AY = 81
Giả sử trong 1 mol Z có x mol X => có (1 – x) mol Y
=> 79,9 = 79x + 81(1 – x)
=> x = 0,55 mol
=> nY : nX = 0,45 : 0,55 = 9 : 11

Đáp án C
, AX = 35 + 44 = 79 . Do nY – nX = 2 => AY = 81
Giả sử trong 1 mol Z có x mol X => có (1 – x) mol Y
=> 79,9 = 79x + 81(1 – x)
=> x = 0,55 mol
=> nY : nX = 0,45 : 0,55 = 9 : 11

a.
X + 2HCl = XCl2 + H2
nX = nH2 = 5,6/22,4 = 0,25 mol
=> X = 6,082/0,25 = 24,328 (Mg)
b.
Mg có Z = 12
Gọi A1, A2, A3 lần lượt là số khối của 3 đồng vị
Tổng số khối của 3 đồng vị là 75
=> A1 + A2 + A3 = 75 (1)
Số khối của đồng vị thứ hai bằng trung bình cộng số khối của hai đồng vị kia
A2 = (A1 + A3)/2 => A1 - 2A2 + A3 = 0 (2)
Lấy (1) trừ (2) => 3A2 = 75 => A2 = 25 => N2 = A2 - Z = 25 - 12 = 13
Đồng vị thứ 3 có số neutron nhiều hơn đồng vị thứ 2 là 1 đơn vị
N3 - N2 = 1 => N3 = 1 + 13 = 14
=> A3 = 12 + 14 = 26
=> A1 = 75 - 26 - 25 = 24
Đồng vị 26Mg trong tự nhiên chiếm 11,4% số nguyên tử
=> %(24Mg, 25Mg) = 100% - 11,4% = 88,6%
Ta có : (88,6 - x)A1 + xA2 + 11,4A3 = 24,328.100
=> x = 10(%)
Vậy thành phần % của 3 đồng vị 24Mg, 25Mg và 26Mg lần lượt là
78,6%, 10% và 11,4%
c.
Giả sử có 100 nguyên tử Mg thì sẽ có
78,6 nguyên tử 24Mg ; 10 nguyên tử 25Mg ; 11,4 nguyên tử 26Mg
Vậy nếu có 50 nguyên tử 25Mg thì sẽ có
393 nguyên tử 24Mg và 57 nguyên tử 26Mg

Chọn C
Số khối của đồng vị thứ nhất là: 79
Số khối của đồng vị thứ hai là: 79 + 2 = 81.
Một cách gần đúng, coi số khối xấp xỉ nguyên tử khối.
Nguyên tử khối trung bình của X là: