Cho 1 hỗn hợp gồm Fe, Ag vào dung dịch HCl dư thu được dung dịch A; 3,2g chất rắn không tan B và 6,72l khí C (đ.k.t.c). Tính % m mỗi kim loại trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B.
Al là kim loại hoạt động hoá học mạnh hơn Fe nên Al phản ứng hết trước. Trường hợp 1 : Al vừa đủ phản ứng, còn Fe không phản ứng và kim loại Ag, Cu được giải phóng.
Al + 3 AgNO 3 → Al NO 3 3 + 3Ag
2Al + 3 Cu NO 3 2 → 2 Al NO 3 3 + 3Cu
Trường hợp 2 : Al phản ứng hết, sau đó đến Fe phản ứng, Fe dư và kim loại Ag, Cu được giải phóng.
Fe + 2 AgNO 3 → Fe NO 3 2 + 2Ag
Fe + Cu NO 3 2 → Fe NO 3 2 + Cu
Chất rắn D gồm Ag, Cu và Fe.

Chọn B.
(1) Đúng, Fe3O4 + 8HCl ® FeCl2 + 2FeCl3 + 4H2O và Cu + 2FeCl3 ® FeCl2 + CuCl2.
(2) Đúng, FeCl2 + AgNO3 ® Fe(NO3)3 + AgCl + Ag.
(3) Sai, Al, Fe bị thụ động hoá bởi dung dịch H2SO4 đặc nguội.
(4) Đúng, 2Na + 2H2O ® 2NaOH + H2 và Al2O3 + 2NaOH ® 2NaAlO2 + H2O.
(5) Đúng, Mg + 2FeCl3 ® MgCl2 + 2FeCl2 sau đó Mg + FeCl2 ® MgCl2 + Fe.
(6) Đúng, Cu và Ag có thể hoà tan được dung dịch chứa ion H+ và NO3–.
(7) Sai, Kim loại cứng nhất là Cr, kim loại có nhiệt độ nóng chảy thấp nhất là Hg.

a)
Gọi $n_{Fe} = a(mol) ; n_{Al} = b(mol) \Rightarrow 56a + 27b = 6,14(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Theo PTHH, ta có :
$m_{muối} = 127a + 133,5b = 15,37(2)$
Từ (1)(2) suy ra a = 0,1 ; b = 0,02
Bảo toàn nguyên tố :
$n_{Fe(NO_3)_3} = a = 0,1(mol)$
$n_{Al(NO_3)_3} = b = 0,02(mol)$
Suy ra:
m = 0,1.242 + 0,02.213 = 28,46(gam)$
\(n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(m_X=56a+27b=6.14\left(g\right)\left(1\right)\)
\(Fe+2HCl\Rightarrow FeCl_2+H_2\)
\(2Al+6HCl\Rightarrow2AlCl_3+3H_2\)
\(m_{Muối}=127a+133.5b=15.37\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.02\)
\(m_{Muối}=m_{Fe\left(NO_3\right)_3}+m_{Al\left(NO_3\right)_3}=0.1\cdot242+0.02\cdot213=28.46\left(g\right)\)
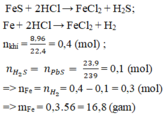
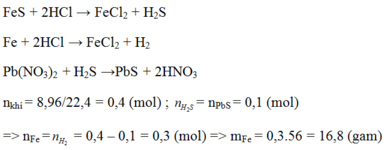

m(rắn)= mAg=3,2(g)
Fe +2 HCl -> FeCl2 + H2
nH2= 0,3(mol) -> nFe=0,3(mol)
=> mFe=0,3. 56=16,8(g)
=> m(hỗn hợp)= mAg+ mFe= 3,2+16,8=20(g)
=> %mAg= (3,2/20).100=16%
=>%mFe=100% - 16%=84%