Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe3O4 mới đúng nhé.không phải Fe2SO4
a,\(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\)
\(n_{Fe3O4}=\frac{4,64}{232}=0,02\left(mol\right)\)
\(\Rightarrow n_{Fe}=0,06\left(mol\right)\)
\(m_{Fe}=0,06.56=3,36\left(g\right)\)
b,\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(n_{H2SO4}=0,05.0,1=0,05\left(mol\right)\)
Tỉ lệ: \(\frac{0,06}{1}>\frac{0,05}{1}\)
Nên Fe dư
\(n_{Fe\left(dư\right)}=0,06-0,05=0,01\left(mol\right)\)
\(m_{Fe\left(dư\right)}=0,01.56=0,56\left(g\right)\)
\(n_{H2}=n_{H2SO4}=0,05\left(mol\right)\)
\(V_{H2}=0,05.22,4=1,12\left(l\right)\)
\(CM_{FeSO4}=\frac{0,05}{0,5}=0,1M\)
\(m_{FeSO4}=0,05.152=7,6\left(g\right)\)

FexOy+yCO\(\rightarrow\)xFe+yCO2(1)
CO2+Ca(OH)2\(\rightarrow\)CaCO3+H2O(2)
- Theo PTHH (2): \(n_{CO_2}=n_{CaCO_3}=\dfrac{7}{100}=0,07mol\)
- Theo PTHH(1) ta thấy: Ooxit+OCO=OCO2
\(\rightarrow\)nO(oxit)=nO(CO2)-nO(CO)=0,07.2-0,07=0,07 mol
mO(oxit)=0,07.16=1,12 gam
m=mFe=4,06-1,12=2,94 gam\(\rightarrow\)nFe=\(\dfrac{2,94}{56}=0,0525mol\)
\(\dfrac{x}{y}=\dfrac{n_{Fe}}{n_O}=\dfrac{0,0525}{0,07}=\dfrac{3}{4}\)
Fe3O4

mFe3O4= 0,58.90%=0,552 tấn
\(Fe_3O_4+4H_2-t^o->3Fe+4H_2O\)
232 --------------------------168
0,552-------------------------x
=> 232x=0,552.168 => x=0,4 ( tấn )
thu được 0,4 tấn Fe
Theo đề ta có PTHH:
Fe3O4 + 4H2 \(\underrightarrow{t^o}\) 3Fe + 4H2O
Theo đề: \(m_{Fe_3O_4}=0,58\times90\%=0,522\) tấn= 522000 gam
=> \(n_{Fe_3O_4}=\dfrac{522000}{232}=2250\left(mol\right)\)
Theo PTHH:
\(n_{Fe}=3n_{Fe_3O_4}=3\times2250=6750\left(mol\right)\)
=> \(m_{Fe}=6750\times56=378000\left(g\right)=0,378\left(tấn\right)\)
Vậy thu được 0,378 tấn

Đáp án D
Ta có: = 0,145 mol
Quy đổi 20,88 g oxit sắt FexOy thành 20,88 g Fe và O
Gọi nFe = x mol; nO = y mol
Quá trình nhường electron:
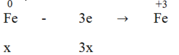
Quá trình nhận electron:
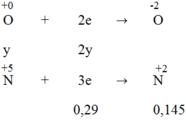
Áp dụng định luật bảo toàn electron, ta có:
3x = 2y + 0,29 → 3x - 2y = 0,29 (1)
Mặt khác: 56x + 16y = 20,88 (2)
Từ (1) và (2) → x = 0,29 và y = 0,29
Muối sinh ra là muối Fe2(SO4)3. Áp dụng ĐL bảo toàn nguyên tố ta có:
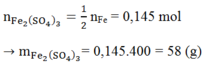

Số mol SO2=0,0375mol
2FexOy+(6x-2y)H2SO4\(\rightarrow\)xFe2(SO4)3+(3x-2y)SO2+(6x-2y)H2O
2(56x+16y) \(\rightarrow\)(3x-2y)mol
17,4g \(\rightarrow\)0,0375mol
112x+32y=464(3x-2y)\(\rightarrow\)1280x=960y\(\rightarrow\)\(\dfrac{x}{y}=\dfrac{960}{1280}=\dfrac{3}{4}\)
Fe3O4
Số mol Fe2(SO4)3=\(\dfrac{x}{3x-2y}n_{SO_2}=\dfrac{3}{9-8}.0,0375=0,1125mol\)
m=0,1125.400=45g

BÀI GÌ MÀ KHÓ THẾ LÀM SAI 90% RỒI .
\(n_{CO}=\dfrac{2,24}{22,4}=0,1mol\)
\(n_{Fe}=\dfrac{3,36}{56}=0,06mol\)
Hỗn hợp khí gồm :CO (a) và \(CO_2\left(b\right)\) . Ta có : a + b = 0,1 mol.(1)
\(d_{\dfrac{hh}{H_2}}=\dfrac{\overline{M_{hh}}}{M_{H_2}}=20,4.\rightarrow\overline{M_{hh}}=20,4.2=40,8\left(g\right)\rightarrow\dfrac{m_{hh}}{n_{hh}}=40,8\rightarrow\dfrac{28a+44b}{a+b}=40,8\rightarrow28a+44b=40,8\left(a+b\right)=40,8.0,1=4,08\left(2\right)\)
Từ (1) và (2) ta có hệ phương trình :
\(\left\{{}\begin{matrix}a+b=0,1\\28a+44b=4,08\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,02\\b=0,08\end{matrix}\right.\)
Gọi công thức của Sắt là \(Fe_xO_y\) . Phương trình hoá học khử oxit sắt bằng khí \(CO_2\) .
\(Fe_xO_y+yCO\underrightarrow{t^o}xFe+yCO_2.\)
c \(\rightarrow\) cx \(\rightarrow\) cy
\(\rightarrow\) cx =0,06 , cy = 0,08 .
Ta có : \(\dfrac{x}{y}=\dfrac{cx}{cy}=\dfrac{0,06}{0,08}=\dfrac{3}{4}\rightarrow x=3;y=4\)
Vậy oxit sắt cần tìm là \(Fe_3O_4.\)

Đáp án C
Ta có: nCO = 0,8 mol; = 0,9 mol
Gọi n là hóa trị của kim loại M (1 ≤ n ≤ 3)
Trong phản ứng giữa M với H2SO4 đặc nóng, M là chất khử nhường electron.
H2SO4 đặc là chất oxi hóa nhận electron:

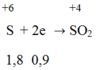
Trong phản ứng khử oxit kim loại bởi CO ta luôn có:
nO (trong oxit) = nCO = 0,8 mol
⇒Tỉ lệ:
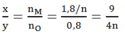
Dựa vào các đáp án ta thấy n = 2 hoặc n = 3


Đáp án B
Do H2SO4 chưa biết nồng độ nên xét 2 trường hợp:
TH1: H2SO4 loãng:
Fe + H2SO4 → FeSO4 + H2
x y
⇒Loại vì x = y
TH2: H2SO4 đặc nóng
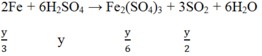
Ta có:
![]()
Do Fe dư nên tiếp tục xảy ra phản ứng:
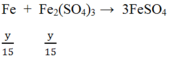
![]()
Vậy Fe hết
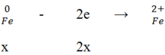
S + 2e → SO2
y y/2
Áp dụng định luật bảo toàn electron ta có: 2x = y
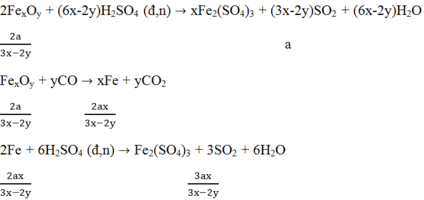
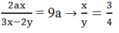
a) Lượng Fe đề bài cho là bao nhiêu?