hòa tan hoàn toàn 11,2 gam kim loại M vào dung dịch HNO3 thu được 4,48 lít khí NO . xác định kim lọai M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Hòa tan hoàn toàn 15,2 gam hỗn hợp gồm Fe và Cu trong dung dịch HNO3, thu được dung dịch X và 4,48 lút khí NO. Cho 3,96 gam kim loại Mg vào X đến khi phản ứng xảy ra hoàn toàn, thu được 224ml khí NO và m gam chất rắn không tan. biết NO là sản phẩm khử duy nhất của N+5. Gía trị cảu m là
A. 6,4 B.12,8 C.9,6 D.4,8

Chọn D
Bảo toàn electron có: 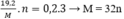 (Với n là số electron nhường)
(Với n là số electron nhường)
Vậy n = 2; M = 64 thỏa mãn. Kim loại cần tìm là Cu.

a) \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: A + 2H2O --> A(OH)2 + H2
0,2<--------------0,2<-----0,2
=> \(M_A=\dfrac{8}{0,2}=40\left(g/mol\right)\)
=> A là Ca (Canxi)
b) \(C_M=\dfrac{0,2}{0,5}=0,4M\)

M2O3 + 6 HCl -> 2 MCl3 + 3 H2O
nH2= 0,075(mol)
=>M(M2O3)=1,35/0,075=
Nói chung bài này số nó cứ lì kì á

Đáp án : D
Nếu hóa trị của X là n. bảo toàn e :
2 n H 2 = n.nX => nX = 0,4/x (mol)
=> MX = 28n
Với n = 2 thì MX = 56(Fe) (TM)

Ta có: \(\left\{{}\begin{matrix}n_{NO}+n_{N_2}=\dfrac{5,6}{22,4}\\30n_{NO}+28n_{N_2}=7,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NO}=0,1\left(mol\right)\\n_{N_2}=0,15\left(mol\right)\end{matrix}\right.\)
Giả sử M có số oxi hóa n.
BT e, có: n.nM = 3nNO + 10nN2
\(\Rightarrow n_M=\dfrac{1,8}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{21,6}{\dfrac{1,8}{n}}=12n\left(g/mol\right)\)
Với n = 2 thì MM = 24 (g/mol) là thỏa mãn.
Vậy: M là Mg.
