đốt cháy 5,6 gam bột fe trong bình đựng o2 thu được 7,36g hỗn hợp A gồm Fe, Fe2O3, Fe3O4,FeO. Hòa tan hoàn toàn A bằng H2SO4 đặc nóng thu được Fe2(SO4)3 và V(l) khí SO2(đktc). Tính V=?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


MX= 19.2=38
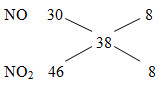
=> nN2=nNO2=x
mFe + mO = moxit
=> mO = moxit- mFe = 7,36-5,6=1,76 gam
=> nO = 0,11 mol
Fe0 →Fe3+ + 3e
0,1 0,3
O0 +2e →O2- N+5 + 3e → N+2 N+5 +1e → N+4
0,11 0,22 3x x x x
Bảo toàn e: 0,3 = 0,22+3x+x =0,22+4x =>x= 0,02
=> nkhí = 2x=0,04 mol
=> Vkhí = 0,04.22,4=0,896 lít=896 ml

nFe = 0,1 mol. m O2 = 7,36 - 5,6 = 1,76 gam => n O2 = 0,055 mol
Đặt nNO = x, nNO2 = y
Ta có hệ: bảo toàn electron: 3.0,1 - 0,055.4 = 3x + y
30x + 44y / ( x+y) = 19.2
=> x= 0,02, y =0,02
=> V = 0,04.22,4 = 8,96 lít

Coi X gồm Fe và O.
Ta có: 56nFe + 16nO = 49,6 (1)
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 3nFe - 2nO = 2nSO2 = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,7\left(mol\right)\\n_O=0,65\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_O=\dfrac{0,65.16}{49,6}.100\%\approx20,97\%\)
Muối thu được là Fe2(SO4)3
BTNT Fe, có: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,35\left(mol\right)\)
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,35.400=140\left(g\right)\)

Đáp án : B
Nếu NaOH dư => n F e O H 3 = 0,2 mol
=> nFe(bd) = 0,2 mol
=> nO(bd) = 0,5 mol. Vô lý
(Vì số mol O trong oxit cao nhất là gấp 1,5 lần số mol Fe).
Vậy NaOH thiếu : 19,2 F e : a O : b
56a + 16b = 19,2
n H 2 S O 4 = 0 , 9
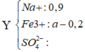
→ B T D T n S O 4 2 - = 0 , 3 + 3 a 2
→ B T N T . S n S O 2 = 0 , 9 - 0 , 3 + 3 a 2 a
6a – 2b = 1,5 ⇒ a = 0 , 3 b = 0 , 15 → V = 6 , 72

Đáp án : A
Do H2SO4 đặc dư => phản ứng tạo Fe3+
=> nkết tủa = nFe(OH)3 = 0,2 mol
Mà nNaOH = 0,9 mol > 3nFe(OH)3 => nOH trung hoà = 0,9 – 3.0,2 = 0,3 mol
=> nH2SO4 phản ứng X = 0,75 mol
Coi X gồm x mol Fe và y mol O
=> nH+ = 6nFe - 2nO = > 1,5 = 6x – 2y
, mX= 56x + 16y =19,2g
=> x = 0,3 mol ; y = 0,15 mol
=> BT e : nSO2.2 + nO.2= 3nFe => nSO2 = 0,3 mol
=> VSO2 = 6,72 lit
