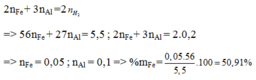hòa tan 12g hỗn hợp gồm Al, Ag vào dd H2SO4 loãng dư. Pư kết thúc thu đc 13,44 l khí H2(đktc).Thành phần % khối lượng của Ag trong hỗn hợp là bn?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Cho Al và Ag phản ứng với H 2 S O 4 loãng, dư chỉ có Al phản ứng.
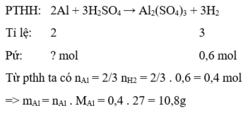
% m A l = 10,8 12 .100 % = 90 % .
% m A g = 100 % - 90 % = 10 %

\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
_____0,4<-----------------------------------0,6
=> \(\%Al=\dfrac{0,4.27}{12}.100\%=90\%\)
%Ag = 100% - 90% = 10%

910% và 100%
Sai thôi nha , mk hok ngu Hóa lém ( mặc dù đã hok lp 10 )

Theo bài ra, ta có: \(m_{Ag}=5,6\left(g\right)\)
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
a) Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) \(\Rightarrow n_{Al}=\dfrac{1}{15}\left(mol\right)\) \(\Rightarrow m_{Al}=\dfrac{1}{15}\cdot27=1,8\left(g\right)\)
\(\Rightarrow\%m_{Al}=\dfrac{1,8}{1,8+5,6}\cdot100\%\approx24,32\%\) \(\Rightarrow\%m_{Ag}=75,68\%\)
b) Theo PTHH: \(n_{H_2SO_4}=n_{H_2}=0,1mol\) \(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,1}{0,1}=1\left(M\right)\)
c) PTHH: \(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2H_2O\)
Theo PTHH: \(n_{Ba\left(OH\right)_2}=n_{H_2SO_4}=0,1mol\)
\(\Rightarrow V_{ddBa\left(OH\right)_2}=\dfrac{0,1}{0,2}=0,5\left(l\right)=500\left(ml\right)\)

Đáp án A
Đặt nFe = a và nAl = b.
+ Phương trình theo khối lượng hỗn hợp: 56a + 27b = 9,65 (1)
+ Phương trình bảo toàn e là: 2a + 3b = 2nH2 = 0,65 (2)
+ Giải hệ (1) và (2) ⇒ nAl = b = 0,15 mol
⇒ %mAl = 0,15×27/9,65 × 100 ≈ 41,97%

Bài 1:
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Fe}\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{37,6}\cdot100\%\approx14,89\%\)
\(\Rightarrow\%m_{Fe_2O_3}=85,11\%\)
Bài 3:
PTHH: \(2HNO_3+Ba\left(OH\right)_2\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{HNO_3}=0,05\cdot1=0,05\left(mol\right)\\n_{Ba\left(OH\right)_2}=\dfrac{342\cdot5\%}{171}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,05}{2}< \dfrac{0,1}{1}\) \(\Rightarrow\) Axit p/ứ hết, Bazơ còn dư sau p/ứ
\(\Rightarrow\) Dung dịch sau p/ứ làm quỳ tím hóa xanh
Theo PTHH: \(n_{Ba\left(NO_3\right)_2}=\dfrac{1}{2}n_{HNO_3}=0,025\left(mol\right)\) \(\Rightarrow m_{Ba\left(NO_3\right)_2}=0,025\cdot261=6,525\left(g\right)\)

Đáp án A
n H 2 = 0 , 2 ( m o l )
=> mhh= mFe + mAl
Bảo toàn electron: