Một bình điện phân dùng để mạ bạc, có dòng điện 2 A chạy qua. Giả sử dòng điện này chỉ do ion Ag+ tạo ra. Tính số nguyên tử Ag bám vào cathode trong 20 phút.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo định luật I của Fa-ra-đây về điện phân, khối lượng bạc tới bám vào catôt tính bằng :
m = kIt
Từ đó suy ra dòng điện chạy qua bình điện phân phải có cường độ :
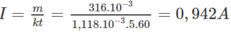
là chưa đúng và kết quả đo của ampe kế có sai số tỉ đối bằng :
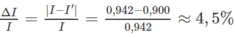

\(m=\dfrac{I.A.t}{F.n}=\dfrac{2.108.3.60}{96500.1}\approx0,4\left(kg\right)\)
\(m=D.V=D.S.h\Rightarrow h=\dfrac{m}{D.S}\approx0,056\left(m\right)\)

Lời giải:
Ta có khối lượng bạc bám ở cực âm: m = 1 F . A n I t → I = m F n A t = 27.96500.1 108.60.60 = 6 , 7 A
Đáp án cần chọn là: A

Đáp án A. Áp công thức của 2 định luật Faraday suy ra I = m n F A t = 27 . 1 . 96500 108 . 3600 = 6 , 7 A
