Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$n_{C_2H_2} = n_{Ag_2C_2} = \dfrac{24}{240} = 0,1(mol)$
$\Rightarrow n_A = n_X - n_{C_2H_2} = 0,2(mol)$
Ta có :
$0,1.26 + 0,2.A = 13,8 \Rightarrow A = 56(C_4H_8)$
Vậy A là $C_4H_8$
CTCT :
$CH_2=CH-CH_2-CH_3$ : But-1-en
$CH_3-CH=CH-CH_3$ : But-2-en
$CH_2=C(CH_3)-CH_3$ : 2-metyl propen
b)
PTHH : $CH_3-CH=CH-CH_3 + H_2O \xrightarrow{t^o,H^+} CH_3-CH_2-CH(OH)-CH_3$
c) Sai đề

Ta có: \(n_X=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
\(n_{C_2Ag_2}=\dfrac{48}{240}=0,2\left(mol\right)=n_{C_2H_2}\)
\(\Rightarrow m_{C_2H_2}=0,2.26=5,2\left(g\right)\)
\(n_{Br_2}=\dfrac{88}{160}=0,55\left(mol\right)=n_{C_2H_4}+2n_{C_2H_2}\)
\(\Rightarrow n_{C_2H_4}=0,55-0,2.2=0,15\left(mol\right)\)
\(\Rightarrow m_{C_2H_4}=0,15.28=4,2\left(g\right)\)
\(\Rightarrow n_{CH_4}=0,45-0,15-0,2=0,1\left(mol\right)\)
\(\Rightarrow m_{CH_4}=0,1.16=1,6\left(g\right)\)

\(V_{C_2H_6}=13,44-6,72=6,72\left(l\right)\)
=> \(n_{C_2H_6}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{C_2Ag_2}=\dfrac{24}{240}=0,1\left(mol\right)\)
=> \(n_{C_2H_2}=0,1\left(mol\right)\)
=> \(n_{C_2H_4}=\dfrac{13,44}{22,4}-0,3-0,1=0,2\left(mol\right)\)
=> \(\left\{{}\begin{matrix}\%m_{C_2H_6}=\dfrac{0,3.30}{0,3.30+0,2.28+0,1.26}.100\%=52,326\%\\\%m_{C_2H_4}=\dfrac{0,2.28}{0,3.30+0,2.28+0,1.26}.100\%=32,558\%\\\%m_{C_2H_2}=\dfrac{0,1.26}{0,3.30+0,2.28+0,1.26}.100\%=15,116\%\end{matrix}\right.\)

Chọn D
C2H2 + AgNO3 -> Ag2C2↓
=> nkết tủa = nC2H2 =0,04 mol
,mbình tăng = mC2H2 + mC2H4 = 2,72g => nC2H4 = 0,06 mol
Đốt cháy : nCO2 = 2nC2H2 + 2nC2H4 = 0,2 mol
nOH = 0,15 mol < nCO2
=> phản ứng chỉ tạo HCO3 với số mol là 0,15 mol
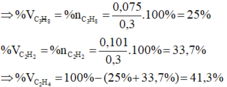
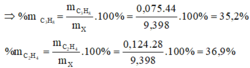



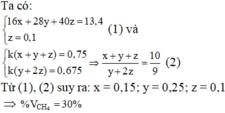
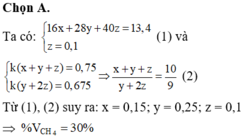
Khi dẫn X qua AgNO3/NH3 thì chỉ có propin phản ứng
CHΞC-CH3 + AgNO3 + NH3 → AgCΞC-CH3 ↓ + NH4NO3
nAgCΞC-CH3 = \(\dfrac{29,4}{147}\)= 0,2 mol = nPropin
Nếu dẫn X qua bình đựng dd brom dư thì khối lượng bình tăng = mPropin + m Etilen
<=> 12,2 = mPropin + m Etilen
<=> 0,2.40 + mEtilen = 12,2
<=> mEtilen = 4,2 gam => nEtilen = 4.2:28 = 0,15 mol
nX = 10,08 : 22,4 = 0,45 mol
=> %V Etilen = \(\dfrac{0,15}{0,45}\).100% = 33,33%
%V Propin = \(\dfrac{0,2}{0,45}\).100% = 44,44%
=> %V Metan = 100 - 33,33 - 44,44 = 22,23%