Đốt cháy x mol Fe bởi oxi thu được 5,04 gam hỗn hợp A gồm oxit sắt. Hòa tan hoàn toàn A trong dung dịch HNo3 thu được 0,035mol hỗn hợp Y gồm No, NO2. Tỉ khối hơi của Y đối với H2 là 19. Tìm x
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giả sử: \(\left\{{}\begin{matrix}n_{NO}=x\left(mol\right)\\n_{NO_2}=y\left(mol\right)\end{matrix}\right.\)
Theo đầu bài, có hệ: \(\left\{{}\begin{matrix}x+y=0,035\\30x+46y=1,33\end{matrix}\right.\)
\(\Leftrightarrow x=y=0,0175\left(mol\right)\)
Quy đổi hỗn hợp A về Fe và O.
Giả sử: \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_O=b\left(mol\right)\end{matrix}\right.\)
⇒ 56a + 16b = 5,04 (1)
Các quá trình:
\(Fe^0\rightarrow Fe^{+3}+3e\)
a___________ 3a (mol)
\(O_2^0+4e\rightarrow2O^{-2}\)
____2b____b (mol)
\(N^{+5}+3e\rightarrow N^{+2}\)
____0,0525_0,0175 (mol)
\(N^{+5}+1e\rightarrow N^{+4}\)
____0,0175_0,0175 (mol)
Theo ĐLBT mol e, có: 3a = 2b + 0,0525 + 0,0175
⇒ 3a - 2b = 0,07 (2)
Từ (1) và (2) ⇒ a = b = 0,07 (mol)
\(\Rightarrow x=m_{Fe}=0,07.56=3,92\left(g\right)\)
Bạn tham khảo nhé!

Đáp án C
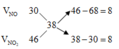
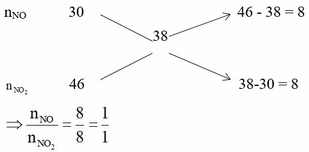
Áp dụng sơ đồ đường chéo cho hỗn hợp NO2 và NO ta có :
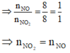
Đặt nFe = nCu = 0,1 mol.
Bảo toàn e
![]()
=> 0,1.3 + 0,1.2 = x + 3x => x = 0,125 mol
![]()
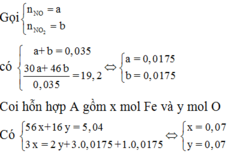
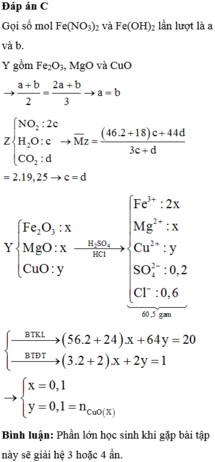

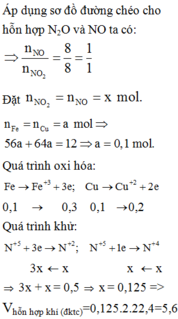
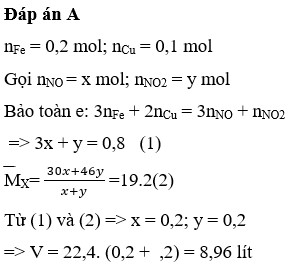
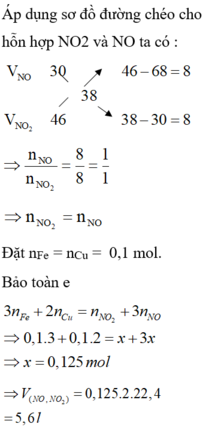


Theo gt ta có: $n_{NO}=n_{NO_2}=0,0175(mol)$
Quy hỗn hợp A về Fe và O với số mol lần lượt là a;b(mol)
Ta có: $56a+16b=5,04(g);3a-2b=0,07(mol)$
Suy ra $a=b=0,07$
Vậy x=0,07
Coi A gồm Fe(x mol) ; O(y mol)
Suy ra: 56x + 16y = 5,04(1)
Gọi : \(\left\{{}\begin{matrix}n_{NO}=a\left(mol\right)\\n_{NO_2}=b\left(mol\right)\end{matrix}\right.\)
Suy ra: \(\left\{{}\begin{matrix}a+b=0,035\\30a+46b=0,035.2.19\end{matrix}\right.\)
Suy ra: a = 0,0175 ; b = 0,0175
\(Fe^0 \to Fe^{+3} + 3e\\ 2e+O^0 \to O^{-2} \\ 3e + N^{+5} \to N^+{+2}\\ 1e + N^{+5} \to N^{+4}\)
Bảo toàn e :
3x = 2y + 0,0175.3 + 0,0175.1(2)
(1)(2) suy ra: x = 0,07 ; y = 0,07
Vậy x = 0,07