Hãy tính thể tích chất khí ở điều kiện tiêu chuẩn (250C và áp suất 1 bar) có trong 0,6 mol khí Hidro
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right)\)
b) \(n_{Al}=\dfrac{13,5}{27}=0,5\left(mol\right)\)
c) \(n_{CO_2}=\dfrac{11}{44}=0,25\left(mol\right)\)
d) \(m_{O_2}=\dfrac{4,958.0,99}{0,082.\left(273+25\right)}=0,2\left(mol\right)\)
e) \(m_{CH_4}=\dfrac{12,359.0,99}{0,082\left(273+25\right)}=0,5\left(mol\right)\)
a: \(n=\dfrac{28}{56}=0.5\left(mol\right)\)
b: \(n=\dfrac{13.5}{27}=0.5\left(mol\right)\)

Điều kiện tiêu chuẩn : nhiệt độ 0oC , áp suất 1 atm.
Thể tích mol phân tử của chất khí là thể tích chứa 6,022.1023 phân tử khí hay 1 mol chất khí.
Ở đktc , thể tích của 1 mol chất khí bằng 22,4 lít.
Người ta quy ước điều kiện thường là ở nht độ 20oC và áp suất 1 atm.
Điều kiện tiêu chuẩn : nhiệt độ 0oC , áp suất 1 atm
Thể tích mol phân tử của chất khí là thể tích chứa 6.1023 phân tử khí hay 1 mol chất khí. -
Ở đktc , thể tích của 1 mol chất khí bằng 22,4 lít.
- Người ta quy ước điều kiện thường là ở nht độ 20oC và áp suất 1 atm.

Chọn đáp án C
Áp dụng phương trình trạng thái cho khí lí tưởng ta có:
p 1 V 1 T 1 = p 2 V 2 T 2 → T h a y s o 750.40 27 + 273 = 760. V 2 0 + 273 ⇒ V 2 = 35 , 9 c m 3

Ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25oC), thể tích 1 mol khí là 24,79 lít.
1 mol khí ở đkc (1bar, 25oC) có thể tích 24,79 lít

\(a,V_{H_2\left(25^oC,1bar\right)}=0,1.24,79=2,479\left(l\right)\\ b,V_{CH_4\left(25^oC,1bar\right)}=0,03.24,79=0,7437\left(l\right)\)
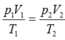
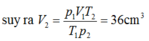

\(V_{H_2}=0,6.24,79=14,874(l)\)
\(VH2=0,6.22,4=13,44\)\((l)\)