Thành phần phần trăm khối lượng của nguyên tố oxi trong công thức hóa học Fe2O3 là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Công thức hóa học: S x O y
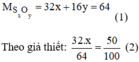
Giải phương trình (2) ta được: x = 1 thay vào pt (1) ⇒ y = 2.
Vậy công thức hóa học của oxit là S O 2

CTHH: AxOy
Có: \(\dfrac{x.M_A}{x.M_A+16y}.100\%=70\%\)
=> \(M_A=\dfrac{112y}{3x}=\dfrac{2y}{x}.\dfrac{56}{3}\)
Xét \(\dfrac{2y}{x}\) = 1 => L
Xét \(\dfrac{2y}{x}=2\) => L
Xét \(\dfrac{2y}{x}=3\) => MA = 56 (Fe) => \(\dfrac{x}{y}=\dfrac{2}{3}\) => CTHH: Fe2O3
Ta có:
\(\%A=70\%\rightarrow\%O=100\%-70\%=30\%\)
Theo quy tắc hóa trị mở rộng:
\(\dfrac{70}{MA}.a=\dfrac{30}{16}.2\) với \(a\) là hóa trị của \(M\)
\(\rightarrow\dfrac{70}{MA}.a=3,75\\ \rightarrow\dfrac{70}{MA}=\dfrac{3,75}{a}\\ \rightarrow3,75.M.A=70a\\ \rightarrow MA=18,6.a\)
Bảng biện luận chạy từ \(1->7\)
| \(a\) | \(1\) | \(2\) | \(3\) | \(4\) | \(5\) | \(6\) |
| \(MA=18,6a\) | \(19\left(loại\right)\) | \(38\left(loại\right)\) | \(56\left(nhận\right)\) | \(74\left(loại\right)\) | \(93\left(loại\right)\) | \(112\left(loại\right)\) |
\(\rightarrow\) Với \(a=3\) thì \(MA=56\) là \(Fe\) mang hóa trị \(III\)
\(\rightarrow CTHH\) của \(A\) là \(Fe_2O_3\)

\(m_{Fe}=180.31,11\%=56\left(g\right)\\ m_N=180.15,56\%=28\left(g\right)\\ m_O=180-56-28=96\left(g\right)\)
\(n_{Fe}=\dfrac{56}{56}=1\left(mol\right)\\ n_N=\dfrac{28}{14}=2\left(mol\right)\\ n_O=\dfrac{96}{16}=6\left(mol\right)\)
\(CTHH:Fe\left(NO_3\right)_2\)
(đề lỗi nên mik sửa Bari thành Sắt nhé chứ Bari nặng tới 137 g/mol)

Bài 2:
\(Đặt.CTTQ.của.A:H_xS_yO_z\left(x,y,z:nguyên,dương\right)\\ Ta.có:\left\{{}\begin{matrix}x=\dfrac{98.2,04\%}{1}=2\\y=\dfrac{98.32,65\%}{32}=1\\z=\dfrac{98.\left(100\%-2,04\%-32,65\%\right)}{16}=4\end{matrix}\right.\\ \Rightarrow x=2;y=1;z=4\\ \Rightarrow CTHH:H_2SO_4\)
Bài 1: Sửa đề 59,2% Al thành 52,9% Al
\(Đặt.CTTQ:Al_xO_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{52,9\%.102}{27}\approx2\\ \Rightarrow y\approx\dfrac{\left(100\%-52,9\%\right).102}{16}\approx3\\ \Rightarrow CTHH:Al_2O_3\)

\(M_{Fe_3O_4}=56.3+16.4=232\left(\dfrac{g}{mol}\right)\)
\(\%Fe=\dfrac{56.3}{232}.100\%=72,4\%\)
\(\%O=\dfrac{16.4}{232}.100\%=27,862\%\)
tìm công thức hóa học của hợp chất có thàn phần các nguyên tố như sau:55,189%K; 14,623%P và còn lại là oxi.Biết 0,05 mol hợp chất có khối lượng là 10,6 gam

Câu 1 :
\(M_{K_2CO_3}=39.2+12+16.3=138\left(dvC\right)\)
\(\%K=\dfrac{39.2}{138}.100\%=56,52\%\)
\(\%C=\dfrac{12}{138}.100\%=8,69\%\)
\(\%O=100\%-56,52\%-8,69\%=34,79\%\)
Còn lại cậu làm tương tự nhá
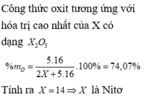
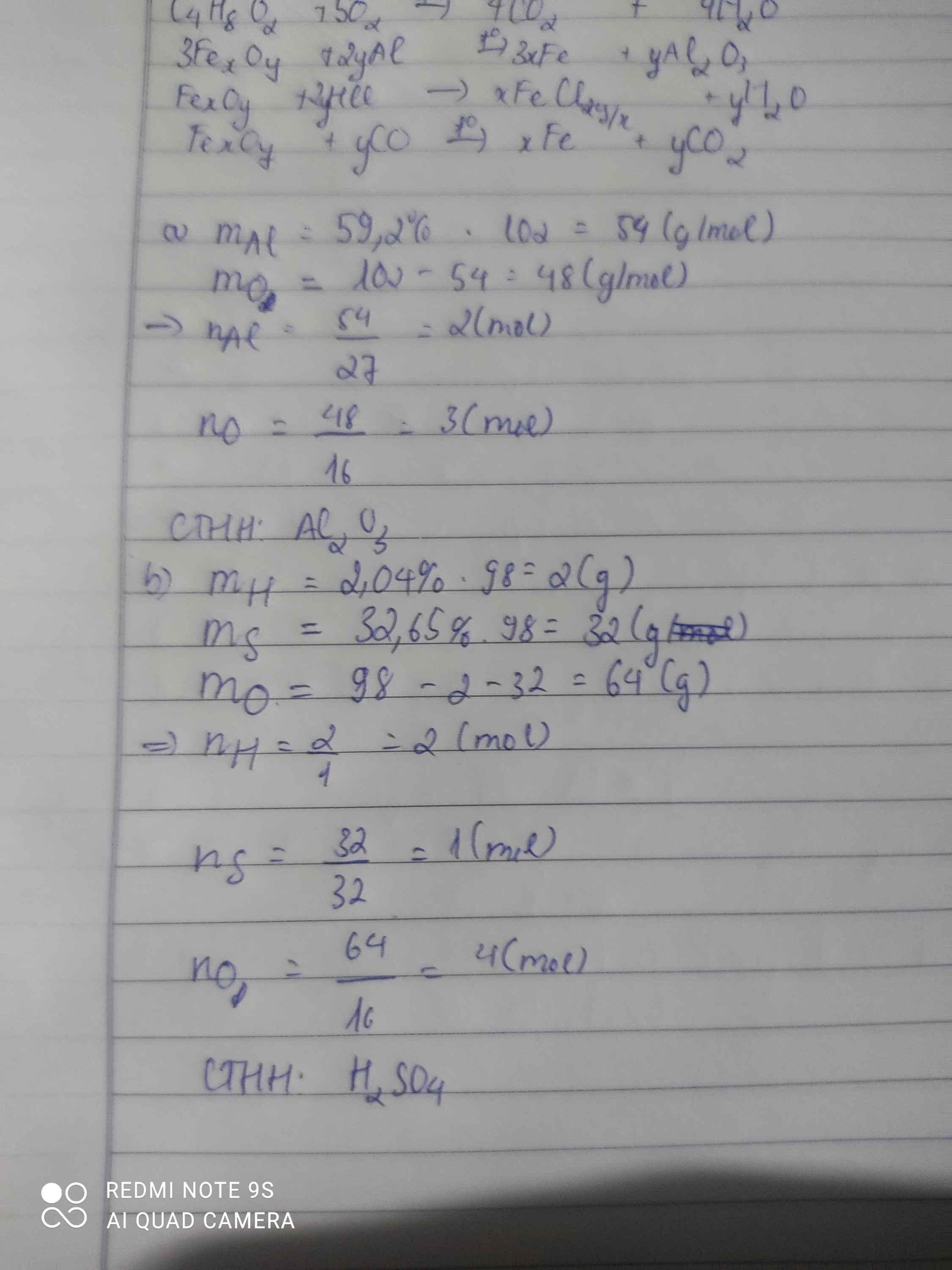
\(M_{Fe_2O_3}=56.2+16.3=160\left(DvC\right)\)
\(\%Fe=\dfrac{56.2}{160}.100\%=70\%\\ \%O=100\%-70\%=30\%\)