cho hỗn hợp 3,68g hh 2 muối CaCO3 và MgCO3 t/d hết với đ HCL thấy bay ra 896ml khí CO2(đktc).%k lượng mỗi muối tỏng hỗn hợp ban đầu là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B.
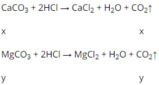
Số mol CO2: 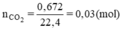
Gọi x, y lần lượt là số mol của CaCO3 và MgCO3 trong hỗn hợp
Theo bài ra ta có hệ phương trình:
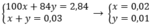
%mNa = 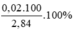 = 70,42%
= 70,42%
%mK = 100% - 70,42% = 29,58%

\(m_{CO_2}=\dfrac{3,36}{22,4}.44=6,6(g)\)
Áp dụng định luật BTKL: \(m_{\text{hh muối}}=m_{\text{hh oxit}}+m_{CO_2}=76+6,6=82,6(g)\)

Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y
\(PTHH_1:CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
(mol) 1 2 1 1 1
(mol) x 2x x x x
\(PTHH_1:MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
(mol) 1 2 1 1 1
(mol) y 2y y y y
Từ 2 PTHH trên ta có hpt:
\(\left\{{}\begin{matrix}100x+84y=2,84\\22,4x+22,4y=0,672\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=\frac{1}{50}\\y=\frac{1}{100}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{CaCO_3}=\frac{1}{50}\left(mol\right)\\n_{MgCO_3}=\frac{1}{100}\left(mol\right)\end{matrix}\right.\)
Ta có:
\(\%n_{CaCO_3}=\frac{0,02.100}{0,03}\approx66,7\left(\%\right)\)
\(\%n_{MgCO_3}=100-66,7=33,3\left(\%\right)\)
Bài 1 : Đặt :
nCaCO3= x mol
nMgCO3= y mol
nCO2= 0.672/22.4= 0.03 mol
mhh= 100x + 84y = 2.84 g (1)
CaCO3 + 2HCl --> CaCl2 + CO2 + H2O
x_________2x_____________x
MgCO3 + 2HCl --> MgCl2 + CO2+ H2O
y__________2y______________y
nCO2= x + y = 0.3 (2)
Giải (1) và (2) :
x = 0.2
y = 0.1
%nCaCO3 = 66.67%
%MgCO3 = 33.33%
nHCl = 2 (x + y ) = 2*0.3= 0.6 mol
mHCl (pư) = 0.6*36.5=21.9 > 2
=> Nếu dùng 2 g HCl không thể hòa tan hết hỗn hợp hai muối ban đầu .

MgCO3 ----> MgO + CO2
CaCO3 -----> CaO + CO2
0,15 (mol) <------------ 0,15 (mol) (1) đây ý nói là tổng lượng mol CO2 = tổng lượng hỗn hợp muối
MgCO3 + HCl -------> MgCl2 + CO2 + H20
CaCO3 + HCl --------> CaCl2 + CO2 + H20
=> n(MgCO3,CaCO3) = n(MgCl2,CaCl2) = 0,15 (mol)
=> M(MgCl2,CaCl2) = 317/3
Sau đó, ta đặt: C (là phần trăm của CaCl2 trong hỗn hợp muối)
1-C (là phần trăm của MgCl2 trong hỗn hợp muối)
Với C là 100% trong hỗn hợp đó
=> 111C + 95x(1-C) = 317/3
Từ đó suy ra: C= 2/3
Vì lượng muối trong hỗn hợp tác dụng với HCl bằng lượng từng muối trong hỗn hợp ban đầu nên
%CaCO3 = 2/3x100% = 66,667%
%MgCO3 = 1/3x100% = 33,33%

- Gọi x,y lần lượt là khối lượng của CaCO3 và MgCO trong hh (x,y >0) (g)
nCaCO3= x(mol)=> mCaCO3= 100x(g)
nMgCO3= y(mol) => mMgCO3= 84y(g)
=> mCaCO3+ mMgCO3= mhh
<=> 100x+ 84y= 2,84 (a)
PTHH: (1) CaCO3 + 2 HCl -> CaCl2 + H2O + CO2
(2) MgCO3 + 2 HCl -> MgCl2 + H2O + CO2
Ta có: nCO2(tổng)= (672:1000):22,4= 0,03(mol)
nCO2(1)= nCaCO3= x(mol); nCO2(2)= nMgCO3= y(mol)
=> nCO2(1) + nCO2(2)= nCO2(tổng)
<=> x+y= 0,03 (b)
Từ (a),(b) ta có hpt:
\(\left\{{}\begin{matrix}100x+84y=2,84\\x+y=0,03\end{matrix}\right.\)
Giaỉ hpt: x= 0,02 ; y= 0,01
=> mCaCO3= 100x= 100. 0,02= 2(g)
=> %mCaCO3= (2/ 2,84).100 \(\approx\) 70,423%
=> %mMgCO3 \(\approx\)100% - 70,423%= 29,577%
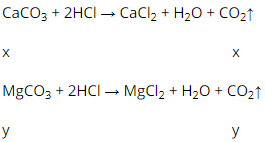
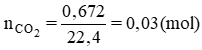
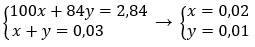
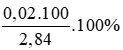 = 70,42%
= 70,42%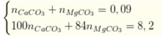
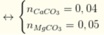
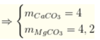

\(n_{CO_2}=0,04\left(mol\right)\\Đặt:n_{CaCO_3}=a\left(mol\right);n_{MgCO_3}=b\left(mol\right)\left(a,b>0\right)\\ CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\\ MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\\ \Rightarrow\left\{{}\begin{matrix}100a+84b=3,68\\a+b=0,04\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,02\\b=0,02\end{matrix}\right.\\ \Rightarrow\%m_{CaCO_3}=\dfrac{0,02.100}{3,68}.100\approx54,348\%\\ \%m_{MgCO_3}\approx100\%-54,348\%\approx45,652\%\)