Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Mg}=0,07mol;n_{Al}=0,08mol\\ n_{Cl_2}=a;n_{O_2}=b\\ 2H^++O^{2-}->H_2O\\ n_{H^+}=0,12\cdot\dfrac{2}{2}=2b\\ b=0,06mol\\ BTDT:0,07\cdot2+0,08\cdot3=2a+4b\\ a=0,07\\ \%V_{Cl_2}=\dfrac{a}{a+b}=53,85\%\)

\(n_{HCl}=0,12.2=0,24\left(mol\right)\)
=> \(n_{H_2O}=0,12\left(mol\right)\)
=> \(n_{O\left(oxit\right)}=0,12\left(mol\right)\)
=> \(n_{O_2}=0,06\left(mol\right)\)
\(n_{Mg}=\dfrac{1,68}{24}=0,07\left(mol\right)\); \(n_{Al}=\dfrac{2,16}{27}=0,08\left(mol\right)\)
Gọi số mol Cl2 là x (mol)
Mg0 - 2e --> Mg+2
0,07->0,14
Al0 - 3e --> Al+3
0,08->0,24
O20 + 4e --> 2O-2
0,06->0,24
Cl20 + 2e --> 2Cl-
x--->2x
Bảo toàn e: 2x + 0,24 = 0,24 + 0,14
=> x = 0,07 (mol)
=> \(\%V_{Cl_2}=\dfrac{0,07}{0,06+0,07}.100\%=53,846\%\)

Chọn C
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích : 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O => nO = ½ nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
,Sau đó : phản ứng với AgNO3 tạo : (2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> %VCl2(X) = 53,85%

Đáp án A
Mol Mg = mol Fe = 0,08 và mol HCl = 0,24
Mg - 2e ---> Mg2+
0,08--0,16
Fe - 3e ---> Fe3+
0,08--0,24
Cl2 + 2e ---> 2 Cl-
a-----2a---------2a
O2 + 4e ---> 2 O2-
b-------4b--------2b
Ag+ + e ---> Ag
x--------x---------x
2 H+ + O2- --> H2O
0,24----0,12
mol O = 2b = 0,12 ==>> b = 0,06
Bảo toàn mol e : 2a + 4b + x = 0,16 + 0,24 = 0,40 ==> 2a + x = 0,16
Kết tủa gồm : AgCl (2a + 0,24) mol và Ag x mol
==> 143,5(2a+0,24) + 108x = 56,69 ==> 287a + 108x = 22,25
===> a = 0,07 và x = 0,02
==> X gồm 0,07 mol Cl2 và 0,06 mol O2 ===> %mol O2 = 46,15

Đáp án A
Mol Mg = mol Fe = 0,08 và mol HCl = 0,24
Mg - 2e ---> Mg2+
0,08--0,16
Fe - 3e ---> Fe3+
0,08--0,24
Cl2 + 2e ---> 2 Cl-
a-----2a---------2a
O2 + 4e ---> 2 O2-
b-------4b--------2b
Ag+ + e ---> Ag
x--------x---------x
2 H+ + O2- --> H2O
0,24----0,12
mol O = 2b = 0,12 ==>> b = 0,06
Bảo toàn mol e : 2a + 4b + x = 0,16 + 0,24 = 0,40 ==> 2a + x = 0,16
Kết tủa gồm : AgCl (2a + 0,24) mol và Ag x mol
==> 143,5(2a+0,24) + 108x = 56,69 ==> 287a + 108x = 22,25
===> a = 0,07 và x = 0,02
==> X gồm 0,07 mol Cl2 và 0,06 mol O2 ===> %mol O2 = 46,15

Đáp án C:
![]()
![]()
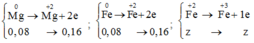
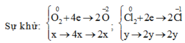
Bảo toàn electron ta có: ne cho= nenhận
![]()
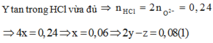
Y tác dụng với AgNO3.
Quá trình trao đổi electron:
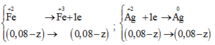
Tạo kết tủa AgCl và Ag => m kết tủa = mAgCl + mAg
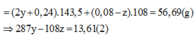
(1) và(2)=>y = 0,07; z = 0,06
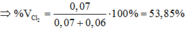

Đáp án : D
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích : 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O => nO = ½ nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
,Sau đó : phản ứng với AgNO3 tạo : (2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> %VCl2(X) = 53,85%



\(n_{H^+} = n_{HCl} = 0,12.2 = 0,24(mol)\\ 2H^+ + O^{2-} \to H_2O\\ n_{O(oxit)} = \dfrac{1}{2}n_{H^+} = 0,12(mol)\\ \Rightarrow n_{O_2} = \dfrac{n_{O(oxit)}}{2} = 0,06(mol)\\ n_{Mg} = \dfrac{1,68}{24} = 0,07(mol) ; n_{Al} = \dfrac{2,16}{27} = 0,08(mol)\)
Bảo toàn electron :
\(2n_{Mg} + 3n_{Al} = 4n_{O_2} + 2n_{Cl_2}\\ \Rightarrow n_{Cl_2} = \dfrac{0,07.2 + 0,08.3-0,06.4}{2} = 0,07(mol)\\ \Rightarrow \%V_{Cl_2} = \dfrac{0,07}{0,07+0,06}.100\% = 53,85\%\)
Đề bài có thiếu dữ kiện k e