Bài 10. Cho 6,72 lít H2 tác dụng với 4,48 lít Cl2 thu được hỗn hợp khí X. Cho hỗn hợp X tác dụng với dung dịch AgNO3 dư thu được 43,05 gam kết tủa trắng. Tính hiệu suất của phản ứng H2 tác dụng với Cl2?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
PTHH: HCl + AgNO3 ---> AgCl↓ + HNO3
0,05<---------------0,05
\(\rightarrow m_{HCl}=0,05.36,5=1,825\left(g\right)\\
\rightarrow C\%_{ddA}=\dfrac{1,825}{50}.100\%=3,65\%\)
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Đặt H = x%
PTHH: Cl2 + H2 --as--> 2HCl
LTL: 6,72 < 10 => H2 dư
=> nHCl = 0,3x (mol)
\(\rightarrow C\%_{HCl}=\dfrac{0,3x.36,5}{0,3x.36,5+385,4}.100\%=3,65\%\\ \Leftrightarrow20,23\%\)

Đáp án B
Các phản ứng tạo kết tủa:
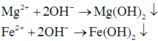
Dung dich X có ![]()
Dung dịch Y có ![]()
Mà ![]() nên OH-dư và
nên OH-dư và ![]()
Vậy ![]()

\(n_{H_2}=\dfrac{1}{22,4}=\dfrac{5}{112}\left(mol\right)\)
\(n_{Cl_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: H2 + Cl2 --as--> 2HCl
Xét tỉ lệ: \(\dfrac{\dfrac{5}{112}}{1}>\dfrac{0,03}{1}\) => Hiệu suất tính theo Cl2
\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
Bảo toàn Cl: \(n_{Cl_2\left(pư\right)}=0,025\left(mol\right)\)
\(H\%=\dfrac{0,025}{0,03}.100\%=83,33\%\)

Đáp án B
nOH- = 2nH2 = 0,4
nCl- = 2nH2 = 0,3
m↓ = 5,2 + 0,3.17 = 10,3 g
mmuối = 5,2+0,3.35,5= 15,85 g
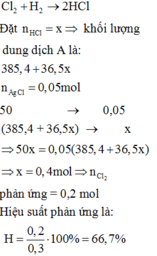


\(n_{AgCl}=\dfrac{43.05}{143.5}=0.3\left(mol\right)\) \(\Rightarrow n_{HCl}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{6.72}{22.4}=0.3\left(mol\right),n_{Cl_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(H_2+Cl_2\underrightarrow{^{^{t^0}}}2HCl\)
\(0.15....0.15.......0.3\)
\(H\%=\dfrac{0.15}{0.2}\cdot100\%=75\%\)
thank bạn