cho phản ứng FE(NO3)3--->fe203+no2+o2 lấy bao nhiêu gam FE(NO3)để điều chế lượng oxi tác dụng vừa đủ với bải tạo thành 36,72gam oxit
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

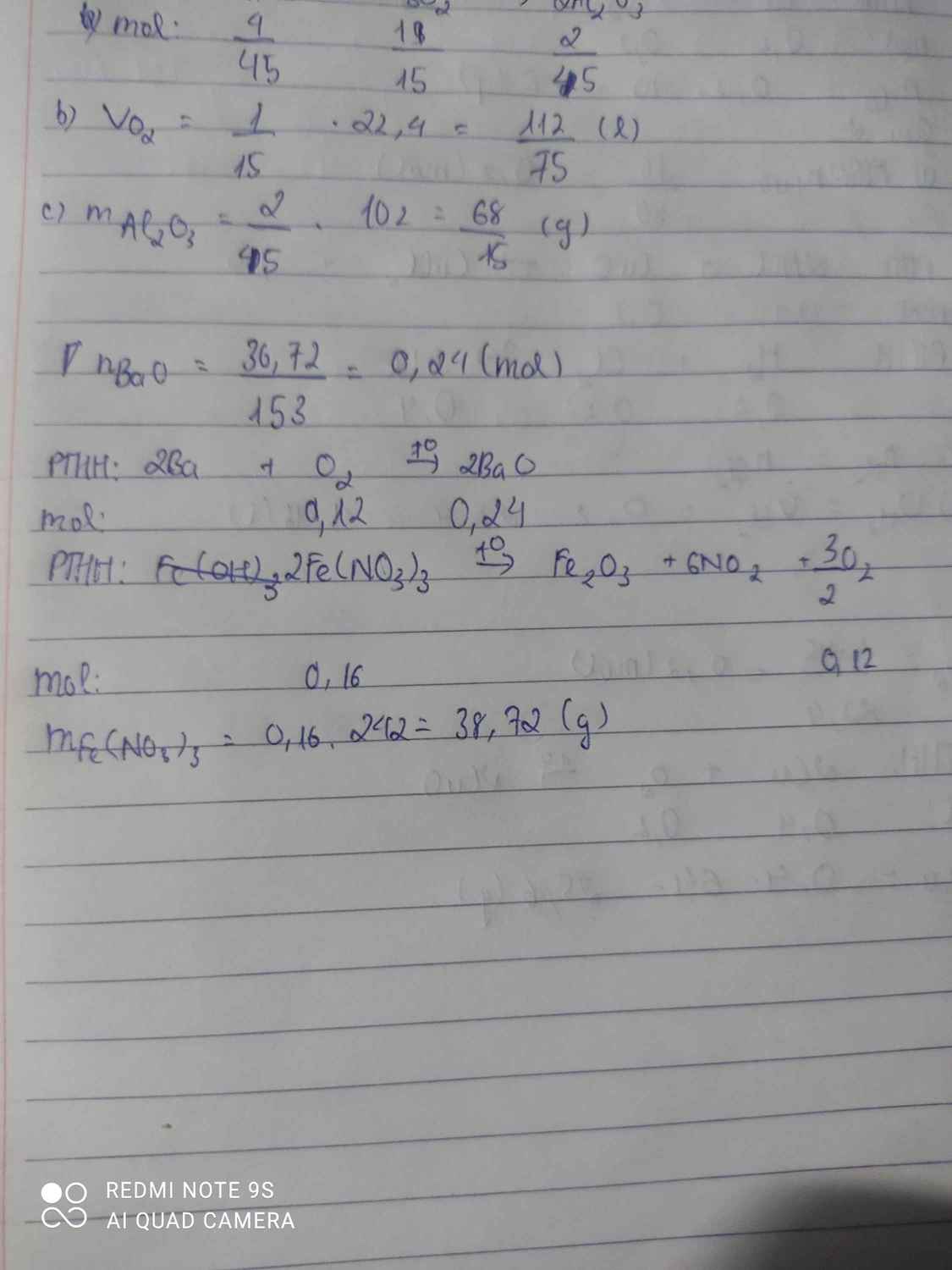

\(n_{Ba}=\dfrac{36,72}{153}=0,24\left(mol\right)\)
PTHH : 2Ba + O2 -> 2BaO
0,24 0,12 0,24
PTHH : 4Fe(NO3)3 \(\underrightarrow{t^0}\) 2Fe2O3 + 12NO2 + 3O2
0,16 0,12
=> \(m_{Fe\left(NO_3\right)_3}=0,16.242=38,72\left(g\right)\)

Chọn đáp án C
Fe tác dụng với dung dịch HNO3 loãng, dư thu được muối Fe(NO3)3
Điện phân dung dịch MgCl2 (dư) thì khối lượng dung dịch giảm bằng khối lượng của Cl2 và H2 và Mg(OH)2 kết tủa.
Cho các chất sau: FeCl2; FeCl3; FeO; Fe3O4; Fe(NO3)2; Fe(NO3)3; HCl và S có cả 8 chất vừa là chất oxi hóa vừa là chất khử

a) nAl2O3= 5,1/102=0,5(mol)
PTHH: 4Al +3 O2 -to-> 2 Al2O3
nO2= 3/2. nAl2O3= 3/2 . 0,05= 0,075(mol)
=>mO2=0,075 x 32= 2,4(g)
b) 2 KMnO4 -to-> K2MnO4 + MnO2 + O2
nKMnO4= 2.nO2= 2. 0,075= 0,15(mol)
=> mKMnO4= 0,15 x 158= 23,7(g)
nAl2O3 = \(\dfrac{5,1}{102}\)=0,05
PTHH
4Al + 3O2 = 2Al2O3
theo phương trình 4 mol : 3 mol : 2 mol
theo đề bài 0,075mol : 0,05mol
mO2 = 0,075. 32= 2,4g
PTHH
2KMnO4 ➜ K2MnO4 + MnO2 + O2
theo phương trình 2mol : 1mol : 1mol : 1mol
theo đề bài 0,05 mol : 0,075 mol
mKMnO4= 0,05. 158= 7,9g

Câu1.a)
1/Chất khử: NH3
Chất oxh : N2
2/Chất khử: Fe
Chất oxh : HNO3
b) 1/ \(QToxh:2N^{-3}\rightarrow\overset{0}{N_2}+6e|\times2\\ QTkhử:\overset{0}{O_2}+4e\rightarrow2O^{2-}|\times3\\ \Rightarrow4NH_3+3O_2\rightarrow2N_2+6H_2O\)
2/ \(QToxh:\overset{0}{Fe}\rightarrow Fe^{+3}+3e|\times1\\ QTkhử:N^{+5}+1e\rightarrow N^{+4}|\times3\\ \Rightarrow Fe+6HNO_3\rightarrow Fe\left(NO_3\right)_3+3NO_2+3H_2O\)
Câu 3. \(Đặt:\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ Mg+2HCl\rightarrow MgCl_2\\ n_{H_2}=0,6\left(mol\right)\\ Tacó:\left\{{}\begin{matrix}x+y=0,6\left(mol\right)\\56x+24y=20,8\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{FeCl_2}=0,2.127=25,4\\m_{MgCl_2}=0,4.95=38\left(g\right)\end{matrix}\right.\)

\(BTKL:m_{O_2}=28-20,8=7,2g\\V_{O_2}=\dfrac{7,2:32}{22,4}=\dfrac{9}{896}l\\ 3Fe+2O_2\xrightarrow[]{t^0}Fe_3O_4\\ 2Cu+O_2\xrightarrow[]{t^0}2CuO\\ n_{Fe}=a;n_{Cu}=b\\ \Rightarrow\left\{{}\begin{matrix}56a+64b=20,8\\\dfrac{1}{3}a232+80b=28\end{matrix}\right.\\ \Rightarrow a=\dfrac{3}{11};b=\dfrac{19}{220}\\ \%m_{Fe}=\dfrac{\left(3:11\right)56}{20,8}\cdot100=73,43\%\\ \%m_{Cu}=100-73,43=26,57\%\)



